
【题目】下列说法不正确的是
A.天然橡胶的主要成分是聚异戊二烯
B.石油主要成分只有烷烃和环烷烃
C.现代工业中石油催化重整是获得芳香烃的主要途径
D.溴乙烷是向有机化合物分子中引入乙基的重要试剂
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I. CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
II. 2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______反应(填”吸热”’或”放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是____(填“a”或“b”)。
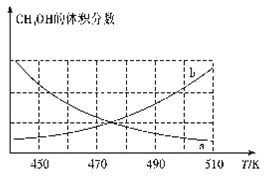
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
①0~4min,反应I的v(H2)=______,反应I的平衡常数K=______。
②反应II中CH3OH的转化率α=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
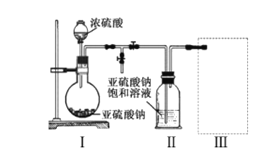
实验一 焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。 装置II中有Na2S2O5晶体析出,发生的反应为: Na2SO3+SO2=Na2S2O5
(1)装置1中产生气体的化学方程式为_____________________
(2)要从装置II 中获得已析出的晶体,可采取的分离方法是_____________________
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___(填序号)。

实验二 焦亚硫酸钠的性质
已知: Na2S2O5 易被氧化,溶于水即生成NaHSO3
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________________。
(5)设计实验证明NaHSO3溶液中HSO3-的电离程度大于水解程度___________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。则定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,滴定终点的现象是______________________________。滴定时消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________kg/L。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果____________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等。

下列装置分别是产品的合成装置和精制装置示意图:

合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2 mL环己醇和25 mL冰醋酸。开动搅拌器,将40 mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5 min。然后,在室温下继续搅拌30 min后,在合成装置中再加入30 mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。回答下列问题:
(1)在合成装置中,甲装置的名称是__________________。
(2)三颈烧瓶的容量为____________(填“50 mL"、“100 mL”或“250 mL")。
(3)滴液漏斗具有特殊的结构,主要目的是__________。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是_________。然后加入精制食盐使之变成饱和溶液,其目的是________。再将混合液倒入分液漏斗中,分离得到有机层。
(5)有机层先加无水MgSO4,用如上右图对粗产品进行精制,加入无水MgSO4的作用是_____。检验精制后的坏己酮是否纯净,可使用的试剂为________________。
A.重铬酸钾溶液B.金属钠C.酚酞溶液 D.新制的氢氧化铜悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.稀的食盐水能杀死H7N9禽流感病毒
B.煤经过分馏和干馏两个物理变化,可变为清洁能源
C.电镀厂的废水直接用来灌溉农田,可提高水的利用率
D.用CO2合成聚碳酸酯可降解塑料,有利于减少白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行可逆反应:2NO2(g)![]() 2NO(g)+O2(g),下列不能说明该反应已达到平衡状态的是
2NO(g)+O2(g),下列不能说明该反应已达到平衡状态的是
A. 混合气体的颜色不再改变 B. 混合气体的密度不再改变
C. 混合气体的压强不再改变 D. 混合气体的平均摩尔质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)暴露于空气中会与氧气反应生成硝酸钠,在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH—==2NO2—+H2O ②气体液化的温度:NO2:21℃,NO:-152℃
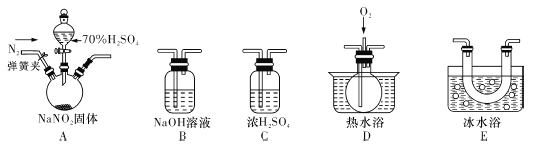
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A、C、 、 、 。
(2)反应前应打开弹簧夹,先通人一段时间氮气,排除装置中的空气,目的是 。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴人70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实骏探究过程,可得出装置A中反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com