
硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可 分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的 SO2、SO3 等气体,再向吸收液中加入浓硫酸,以制取高浓度的 SO2 及(NH4)2SO4和NH4HSO4固体。为了测定测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别 加入相同浓度的 NaOH 溶液 50.00 mL,加热至 120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于 200℃],测得有关实验数据如下(标准状况):
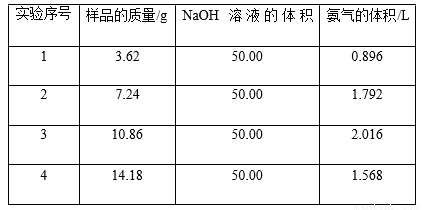
(1)由 1 组数据直接推测:1.81 g 样品进行同样实验时,生成氨气的体积(标准状况)为 L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(3)求所用 NaOH 溶液的物质的量浓度 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届北京市西城区高三上学期期末考试化学试卷(解析版) 题型:选择题
利用右图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法中,正确的是
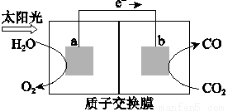
A.该过程是将太阳能转化为化学能的过程
B.电极a表面发生还原反应
C.该装置工作时,H+从b极区向a极区移动
D.该装置中每生成1 mol CO,同时生成1 mol O2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:填空题
有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40 mL 1 mol·L-1的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的微小变化)。
实验序号 | ① | ② | ③ | ④ |
m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
计算:(1)样品中铁和铜的物质的量之比n(Fe)∶n(Cu)=_______________。
(2)实验②的滤液中c(Fe2+)=__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:选择题
在一个容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)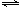 2NH3(g) △H<0
2NH3(g) △H<0 。下列各项能说明该反应已经达到平衡状态的是
。下列各项能说明该反应已经达到平衡状态的是
A.容器内气体压强不再改变
B.N2和H2的物质的量不变且比例为1∶3
C.断裂1mol N≡N键的同时,断裂3 mol H—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:选择题
下列物质的水溶液因水解而呈酸性的是
A.NaHCO3 B.NaNO3 C.CaCl2 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上期末化学卷(解析版) 题型:填空题
请回答下列问题:
(1)在 CO、CO2、SO2、NO、NO2、SiO2中,属于酸性氧化物的是 ,能导致酸雨的是 。
(2)硅酸钠是为数不多的溶于水的硅酸盐,向硅酸钠溶液中通入足量 CO2 有白色沉淀产生,写出该反应的离子反应方程式: 。
(3)有如下反应(未配平):BrF3+H2O→Br2+O2+HBrO3+HF,已知生成物中 Br2 与 O2 的物质的量之比为 1∶1。则:
①配平后 H2O与 HF 物质的量之比为 ;
②还原剂为 ;
③如有 5 mol H2O 参加反应,则参加氧化还原反应的 H2O 物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上期末化学卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.少量的钠投入 Ca( HCO 3 ) 2 溶液中:2Na+2Ca2++2HCO3-=2Na++2CaCO3↓+H2↑
B.硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.大理石与醋酸溶液反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.向 Ba(OH ) 2 溶液中逐滴加入 NH4HSO4 溶液直至过量:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:填空题
A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,B的单质在空气中含量最多, C、D元素同主族且原子序数D 为C的二倍, E元素的价电子排布式为(n-1)dn+6ns1。回答下列问题:
(1)元素B在周期表中的位置是_______;D元素基态原子的核外电子排布式为____________。
(2)E元素能形成E+的原因是_________________________________。
(3)A 元素与C元素形成两种常见的化合物,其原子个数比为1:1 和2:1,写出其原子个数比为1:1的化合物的电子式___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:实验题
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再进行测定。
(1)在高温下将x克钢样中碳、硫转化为CO2、SO2(气体a)。
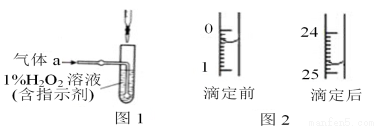
(2)将气体a通入测硫装置中(如图1),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:___________ ______。
②将①的吸收液稀释至250mL,取1/10该溶液进行滴定,用酸式滴定管取液时赶走气泡的操作是_ 。
③用c mol/L 标准 NaOH 溶液滴定取出的溶液,则选择的指示剂为_________,直至加入最后一滴NaOH溶液时,溶液颜色_________,即可停止滴定。
④某次滴定前后,NaOH 溶液的液面如图2,其体积读数为________________________。若滴定3次,消耗NaOH溶液体积的平均值为z mL,则该钢样中硫的质量分数为______________________(用 x、c、z表示)。
⑤下列操作会造成测定结果偏高的是__________。
a.水洗后未用标准液润洗碱式滴定管 b.加入1 mL酸碱指示剂
c.滴定终点时,尖嘴出现气泡 d.滴定终点俯视滴定管的刻度
将气体 a 通入测碳装置中(如图),采用重量法测定碳的含量。

⑥为准确测定CO2,需除去SO2的干扰,除去SO2的装置是_______(填序号)。
⑦计算钢样中碳的质量分数,应测量的数据是__________。去掉装置E,测得碳的质量分数 (填 “偏小”、“无影响”或“偏大”)
⑧上述操作中,测定CO2前先除去SO2,但测定SO2前却没除CO2,是否合理?若不合理,说明如何改正;若合理,说明理由_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com