
正误判断,正确的划“√”,错误的划“×”
(1)在标准状况下,1 mol O2与1 mol SO3的体积相同( )
(2)在标准状况下,1 mol气体的体积约是22.4 L,在非标准状况下,1 mol气体的体积则一定不是22.4 L( )
(3)22.4 L气体在标准状况下是1 mol,在非标准状况下一定不是1 mol( )
(4)在相同条件下,相同物质的量的CO、N2的混合气体与O2的分子个数相同,原子个数也相同( )
(5)在相同条件下,相同物质的量的C2H4和C3H6,所含分子个数相同,原子个数也相同( )
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
如图所示甲~丁四种物质均含有同一种元素,甲可以是单质也可以是气态氢化物,丁是该元素最高价氧化物对应的水化物,则甲、乙、丙、丁四种物质中共同含有的元素可能是( )

A.Cl B.Fe C.C D.N
查看答案和解析>>
科目:高中化学 来源: 题型:
a.b.c.d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
A.d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与其他元素生成的化合物都是离子化合物
D.b.c.d与氢形成的化合物中化学键均为极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)  △H3
△H3
回答下列问题:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是  。
。
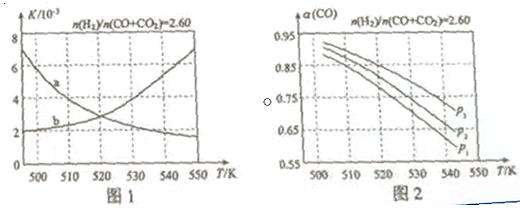
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下有①0.112 L水 ②0.5NA个HCl分子
③25.6 g SO2气体 ④0.2 mol氨气 ⑤2 mol氦气 ⑥6.02×1023个白磷分子,所含原子个数从大到小的顺序为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。根据甲、乙的摩尔质量(M)的关系判断,下列说法中正确的是( )
A.若M(甲)<M(乙),则分子数:甲<乙
B.若M(甲)>M(乙),则气体摩尔体积:甲<乙
C.若M(甲)<M(乙),则气体的压强:甲>乙
D.若M(甲)>M(乙),则气体的体积:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是
A化学反应必然伴随能量变化。
B、需加热才能发生的化学反应一定是吸热反应。
C、化学反应中的能量变化主要是由化学键的断裂和形成引起的。
D、反应物与生成物总能量的相对大小决定反应是吸热或放热。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com