
 ��ҵ���Ի�����Ϊԭ���������ᣬ������Ҫ��һ���Ǵ������������б��ֺ��º�����������2SO2��g��+O2��g��?2SO3��g����H=-196.6kJ•mol-1
��ҵ���Ի�����Ϊԭ���������ᣬ������Ҫ��һ���Ǵ������������б��ֺ��º�����������2SO2��g��+O2��g��?2SO3��g����H=-196.6kJ•mol-1���� ��1���÷�Ӧ��һ����Ӧǰ�����������С�ķ��ȷ�Ӧ�������SO2��ת���ʣ���ı�����ʹƽ��������Ӧ�����ƶ���
��2��A���������֮�ȵ������ʵ���֮�ȼ���ƽ��ʱ��������ܵ����ʵ����������ò���������μӷ�Ӧ�Ķ�����������ʵ���������Ȼ�ѧ����ʽ����ų���������
B�����º�ѹ�����δﵽƽ��״̬��ͬ���������жϣ�
C�����º�ѹ�����δﵽƽ��״̬��ͬ�����ж�
D������A�����֪��ԭƽ��ʱSO3���������Ϊ$\frac{1mol}{4.5mol}$=$\frac{2}{9}$��
��3�����ݻ�ѧƽ������ʽ����ƽ��Ũ�ȣ����ƽ�ⳣ��������㣻
��4��ѹǿ����������SO2ת���ʵı仯�������ԣ����Թ�ҵ��ֱ�Ӳ��ó�ѹ��ƽ�ⳣ�����¶ȱ仯��
��� �⣺��1��A����װ���г��������O2����ѧƽ�������ƶ�������߶�������ת���ʣ���A��ȷ��
B�������¶ȣ���ѧƽ�������ƶ������������ת���ʼ�С����B����
C����װ���г���N2����ѧƽ�ⲻ���ƶ���������߶�������ת���ʣ���C����
D����װ���г��������SO2����������ת���ʽ��ͣ���D����
��ѡ��A��
��2���������������Ϊ��ʹʱ��90%����Ӧ���ܵ����ʵ���Ϊ��ʼʱ��90%��ƽ��ʱ�����ʵ���Ϊ��3mol+2mol����90%=4.5mol����ƽ��ʱ��������ʵ����仯Ϊ��
2SO2+O2?2SO3 ���ʵ������١�n
2 1 2 1
1mol 0.5mol 1mol ��3mol+2mol��-4.5mol=0.5mol
��ʱ�ų�������Ϊ196.6KJ��$\frac{0.5mol}{1mol}$=98.3KJ����A����
B��2SO2+O2?2SO3
��ʼ����mol�� 3 2 0
�仯����mol�� x 0.5x x
ƽ������mol��3-x 2-0.5x x
��Ӧ���ܵ����ʵ���Ϊ��ʼʱ��90%��3-x+2-0.5x+x=4.5��x=1mol����������ת����=$\frac{1mol}{3mol}$��100%=$\frac{1}{3}$��
����ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼ���ʵ�����Ϊ 5mol SO2��g����3.5mol O2��g����1mol SO3��g����ת��Ϊ��ʼ��Ϊ6molSO2��g����4molO2����ѹ����������ƽ��ʱ��Чƽ�⣬ƽ����������ӦΪ4mol��ת����=$\frac{1mol}{5mol}$��100%=20%����B����
C������B������֪��Чƽ��״̬���������������ͬ����C��ȷ��
D��ԭƽ��ʱSO3���������Ϊ$\frac{1mol}{4.5mol}$=$\frac{2}{9}$����D��ȷ��
�ʴ�Ϊ��CD��
��3��500��ʱ��10mol SO2��5.0mol O2�������Ϊ1L�ĺ����ܱ������У�SO2ת��ΪSO3��ƽ��ת����Ϊ0.95����Ӧ�Ķ����������ʵ���=9.5mol��
2SO2 +O2 ?2SO3
��ʼ����mol/L�� 10 5 0
�仯����mol/L�� 9.5 4.75 9.5
ƽ������mol/L�� 0.5 0.25 9.5
��500��ʱ��ƽ�ⳣ��K=$\frac{9��{5}^{2}}{0��{5}^{2}��0.25}$=1.444x103��
�ʴ�Ϊ��1.444x103��
��4����ͼ���п��Կ�������ѹSO2�Ϳ��Դﵽ�ϸߵ�ת���ʣ�ѹǿ����������SO2ת���ʵı仯�������ԣ���ѹ��������Ͷ���Խ�������豸���ṩ�������⣬���Թ�ҵ��ֱ�Ӳ��ó�ѹ��ƽ�ⳣ�����¶ȱ仯������ѹǿ�仯��ƽ�ⳣ�����䣻
�ʴ�Ϊ����ѹ��400��500��C��SO2ת�����Ѿ��ܸ��ˣ���ѹ��������Ͷ���Խ�������豸���ṩ�������⣬=��
���� ���⿼����ƽ��Ӱ�����أ�ƽ����������ע��ƽ�⽨���ͷ�Ӧ����ѡ��ķ��������ݣ�ƽ�ⳣ������Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 ��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 13��8��29 | B�� | 39��24��13 | C�� | 22��11��14 | D�� | 26��16��57 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ba��OH��2��Һ�еμ�NaHSO4��Һ�����ԣ�Ba2++2OH-+2H++SO${\;}_{4}^{2-}$�TBaSO4��+2H2O | |
| B�� | ���Ȼ�����Һ�ͷ�ˮ��Ӧ��ȡ�����������壺Fe3++3H2O����ˮ���TFe��OH��3��+3H+ | |
| C�� | ����ˮ��Ӧ��Na+2H2O=Na++2OH-+H2�� | |
| D�� | ����ʯ��ˮ��ϡ���ᷴӦ��Ca��OH��2+2H+=Ca2++2H20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ������� | ��ʼʱ���������ʵ���/mol | ƽ��ʱ��Ӧ�е������仯 | ||
| N2 | H2 | NH3 | ||
| �� | 1 | 3 | 0 | �ų�����a kJ |
| �� | 2 | 3 | 0 | �ų�����b kJ |
| �� | 2 | 6 | 0 | �ų�����c kJ |
| A�� | N2��ת���ʣ��ڣ��٣��� | B�� | ���������ڷ�Ӧ��ƽ�ⳣ�����ۣ��٣��� | ||
| C�� | ƽ��ʱ����������������٣��� | D�� | �ų�������ϵ��2a��c��184.8 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10mol��10% | B�� | 20mol��40% | C�� | 20mol��20% | D�� | 30mol��80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �� | C�� | �� | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
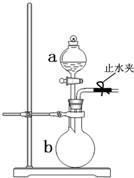 ��ͼ��ʾװ����ʵ���ҳ��õ�������ȡװ�ã���ͼ�ش��������⣺
��ͼ��ʾװ����ʵ���ҳ��õ�������ȡװ�ã���ͼ�ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�ã���ͼΪ���ʾ��ͼ���õ�ص缫�������һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�
����ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�ã���ͼΪ���ʾ��ͼ���õ�ص缫�������һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com