
����Ŀ����������Ȼ���ֲ���У���K1=5.4��10��2 �� K2=5.4��10��5 �� ��������κͼ���������ˮ���������������ˮ�����ᾧ�壨H2C2O42H2O����ɫ���۵�Ϊ101�棬������ˮ��������ˮ��������170�����Ϸֽ⣮��ش��������⣺ 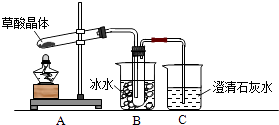
��1������ͬѧ����ͼ1��ʾװ�ã�ͨ��ʵ�������ᾧ��ķֽ���װ��C�пɹ۲쵽�������� �� �ɴ˿�֪���ᾧ��ֽ�IJ������� �� װ��B����Ҫ������ ��
��2������ͬѧ��Ϊ���ᾧ��ֽ�����л���CO��Ϊ������֤��ѡ�ü���ʵ���е�װ��A��B����ͼ��ʾ�IJ���װ�ã������ظ�ѡ�ã�����ʵ�飮 
�� ����ͬѧ��ʵ��װ���У��������ӵĺ���˳��ΪA��B�� �� װ��H��Ӧ����ʢ�е������� ��
����֤�����ᾧ��ֽ��������CO�������� ��
��3�����ʵ��֤���� �ٲ�������Ա�̼���ǿ ��
�ڲ���Ϊ��Ԫ�� ��
��4������Ͳ����ƣ�Na2C2O4�����������������±�KMnO4��Һ��MnO2��������Ԫ�ر���ԭΪ+2�ۣ�KMnO4��Һ�Ͳ�������Һ��ϡ�����з�Ӧ�����ӷ���ʽΪ�� �� ʵ���ҳ��ù�������ƲⶨKMnO4��Һ��Ũ�ȣ�ȷ��ȡ0.2000g�����ƣ�������ƿ�У�����100mLϡ�����ܽ⣬�����ƺõ�KMnO4��Һ�ζ��������ظ�ʵ������KMnO4��Һ������ֱ���16.02mL��16.00mL��16.01mL����KMnO4��Һ�����ʵ���Ũ�ȵļ���ʽ�ǣ�c��KMnO4��= ��
���𰸡�
��1��������ð��������ʯ��ˮ����ǣ�CO2��������ˮ�����Ͳ��ᣩ����ֹ�������װ��C��Ӧ���ɳ���������CO2�ļ���
��2��F��D��G��H��D��I��CuO��H�к�ɫ��ĩ��Ϊ��ɫ������D�г���ʯ��ˮ�����
��3����ʢ������NaHCO3���Թ���μӲ�����Һ�������ݲ�����˵���������Դ���̼���NaOH����Һ�ζ�������Һ������NaOH�����ʵ����Dz����2��
��4��2MnO4��+16H++5C2O42���T2Mn2++10CO2��+8H2O��![]()
���������⣺��1�����ᾧ�壨H2C2O42H2O����ɫ���۵�Ϊ101�棬������ˮ��������ˮ��������170�����Ϸֽ⣬����������ȷֽ⣬�ֽ�ʱ�����������̼��������̼���������Ʒ�Ӧ���������Ե�̼��Ƴ�����ʹ����ʯ��ˮ����ǣ�����C�й۲쵽�������ǣ�������ð���ҳ���ʯ��ˮ����ǣ�˵���ж�����̼���ɣ���������κͼ���������ˮ���������������ˮ�������ӷ����������ɵ������к��в��ᣬ������������Ʒ�Ӧ���������ԵIJ���ƶ����Ŷ�����̼�ļ��飬Bװ���¶Ƚϵͣ����������ã���ֹ���Ŷ�����̼�ļ��飬���Դ��ǣ�������ð��������ʯ��ˮ����ǣ�CO2��������ˮ�����Ͳ��ᣩ����ֹ�������װ��C��Ӧ���ɳ���������CO2�ļ��飻��2����Ҫ��������CO���ڼ���ʵ�����Ũ�������Ƴ�ȥ������̼���ó���ʯ��ˮ���������̼���ü�ʯ�Ҹ���CO������CO��CuO������ԭ��Ӧ����CO2 �� �����ó���ʯ��ˮ�������ɵĶ�����̼������ˮ���ռ�CO�������Ⱦ������������˳����A��B��F��D��G��H��D��I�� Hװ����ʢ�ŵ�����Ӧ�þ��������ԣ��Һ�CO��Ӧ��������������CuO�ܱ�CO��ԭ�ҷ�Ӧ�����к�ɫ�����Ϊ��ɫ���������ԣ�����H��ʢ�ŵ�������CuO��
���Դ��ǣ�F��D��G��H��D��I��CuO����CO���л�ԭ�ԣ������������Ƕ�����̼��������̼��ʹ����ʯ��ˮ����ǣ���CO����ɫ��CuO��ԭΪ��ɫ��Cu��ֻҪH�к�ɫ����ת��Ϊ��ɫ������Dװ����Һ����Ǿ�˵������CO��
���Դ��ǣ�H�к�ɫ��ĩ��Ϊ��ɫ������D�г���ʯ��ˮ����ǣ�3����Ҫ֤���������Դ���̼�ᣬ��������ǿ����ȡ���ᣬ��ʢ������NaHCO3���Թ���μӲ�����Һ�������ݲ�����˵���������Դ���̼�ᣬ���Դ��ǣ���ʢ������NaHCO3���Թ���μӲ�����Һ�������ݲ�����˵���������Դ���̼�
�ڲ����NaOH�����кͷ�Ӧʱ����������Ƕ�Ԫ�ᣬ��μӷ�Ӧ�IJ������ʵ���Ӧ����NaOH��һ�룬������NaOH����Һ�ζ�������Һ������NaOH�����ʵ����Dz����2����˵�������Ƕ�Ԫ�ᣬ���Դ��ǣ���NaOH����Һ�ζ�������Һ������NaOH�����ʵ����Dz����2������4����KMnO4�Ͳ�������ϡ�����з�Ӧ��������ء������ơ������̡�������̼��ˮ����Ӧ�����ӷ���ʽΪ��2MnO4��+5C2O42��+16H+=2Mn2++10CO2��+8H2O�����Դ��ǣ�2MnO4��+5C2O42��+16H+=2Mn2++10CO2��+8H2O���ڸ��������������ݼ�����������Һ���ƽ��ֵΪ= ![]() =16.01mL������KMnO4��Һ��Ũ��Ϊc��n��C2O42����=
=16.01mL������KMnO4��Һ��Ũ��Ϊc��n��C2O42����= ![]() ����
����
2MnO4��+16H++ | 5C2O42��=2Mn2++10CO2��+8H2O |
2mol | 5mol |
c��0.01601L |
|
���c= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ȡ���ά��ԭ�ϵ��� �� ��
A. ���ʹ�B. ��������C. ������D. þ���Ͻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���壨�ᾧˮ��������ֶ�����Ԫ����ɣ������£����þ�����������ˮ��ɵ�����������ӣ�����ˮ�ĵ��룩�������������Ӻ��еĵ�������Ϊ10����������Һ�ֳɵ���2�ݣ�һ���м�������ϡ���ᣬ�����������ټ���BaCl2��Һ��������ɫ����������һ������μ���NaOH��Һ�����������ɳ��������ʵ��������NaOH��Һ�������ϵ��ͼ��ʾ�� 
��ش��������⣺
��1�����þ����Ħ������Ϊ906gmol��1 �� д���þ���Ļ�ѧʽ��
��2��B����Һ��pH7�����������������=�������û�ѧ�����ʾ��ԭ�� ��
��3������þ����ˮ��Һ����μ���Ba��OH��2��Һ���������ij�����д���ñ仯�����ӷ���ʽ ��
��4��C����Һ���������ʵĻ�ѧʽΪ����ʱ��Һ�и�������Ũ���ɴ�С˳��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��CO�Ǻϳ������л����ԭ�ϣ������·�Ӧ��mH2+nCO==wX(��Ӧ������ʡȥ��m��n��wΪ��ѧ������)����m��n=l��1��w=l�����л���X�����Ǣ�HCHO��C2H5OH ��CH3COOH ��CH3CHO �е�
A. �ٺ͢� B. �ٺ͢� C. �ں͢� D. �ٺ͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ƽ�ȩ��NaHSO2HCHO2H2O���׳Ƶ��飬���ȶ���120��ʱ��ֽ⣮��ӡȾ��ҽҩ�Լ�ԭ���ܹ�ҵ���й㷺Ӧ�ã���Na2SO3��SO2��HCHO��п��Ϊԭ���Ʊ����������Ƽ�ȩ��ʵ�鲽����ͼ��
����1����������ƿ�м���һ����Na2SO3��ˮ�������ܽ⣬����ͨ��SO2 �� ����ҺpH ԼΪ4���Ƶ�NaHSO3��Һ��
����2����װ��A �е����ܻ�����Ƥ��������ƿ�м����Թ�����п�ۺ�һ������ȩ��Һ����80��90���£���ӦԼ3h����ȴ�����£����ˣ�
����3������Һ�������Ũ������ȴ�ᾧ��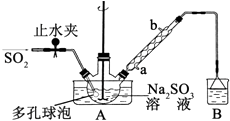
��1��װ��B ���ձ���Ӧ�������Һ��������������ȴˮ�����a����b�����ڽ�ˮ��
��2��A�ж�����ݵ������� ��
��3���������л�������Ҫ���ʳ�H2O ������ѧʽ����
��4��д������2�з�����Ӧ�Ļ�ѧ����ʽ ��
��5������3�����������������Ũ����ԭ���� ��
��6��Ϊ�˲ⶨ��Ʒ�Ĵ��ȣ�ȷ��ȡ2.0g��Ʒ����ȫ����ˮ���100mL��Һ��ȡ20.00mL������Һ�������������ȫ��Ӧ����֪I2����������ȩ�����ʲ���Ӧ��������BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������صõ���ɫ����0.466g�������ƵõIJ�Ʒ�Ĵ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2013�������������������ص����������������ǵij��м���������˼����Σ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
��1�������Ƽ�ѭ�������ѳ������е�SO2 �� �����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ�� ��
������Һ����SO2�Ĺ����У�pH��n��SO32������n��HSO3�����仯��ϵ���±���
n��SO32������n��HSO3���� | 91��9 | 1��l | 9��91 |
pH | 8.2 | 7.2 | 6.2 |
���ϱ��жϣ�NaHSO3��Һ���ԣ���ᡱ��������С������û�ѧƽ��ԭ�����ͣ� ��
�۵�����Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ���£�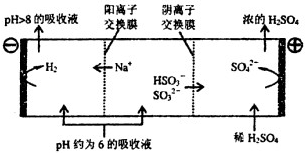
д��HSO3���������ŵ�ĵ缫��Ӧʽ�� �� ������������ҺpH����8����ʱ������Һ������ѭ�����ã�
��2����CH4����ԭNOx�������������������Ⱦ�����磺 CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g������H=��574kJmol��1
CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g������H=��1160kJmol��1
���ñ�״����4.48L CH4��ԭNO2��N2 �� ����������ת�Ƶĵ�������Ϊ������٤��������ֵ��NA��ʾ�����ų�������ΪkJ��
��3����ҵ�Ϻϳɵ������������Ʊ������У����е�һ����ӦΪ��CO��g��+H2O��g�� ![]() CO2��g��+H2��g������H��0 һ�������£���CO��g����H2O��g���������Ϊ1��2�����ܱ������з���������Ӧ���ﵽƽ��ʱ���CO��g����H2O��g�������Ϊ1��6����ƽ�ⳣ��K= ��
CO2��g��+H2��g������H��0 һ�������£���CO��g����H2O��g���������Ϊ1��2�����ܱ������з���������Ӧ���ﵽƽ��ʱ���CO��g����H2O��g�������Ϊ1��6����ƽ�ⳣ��K= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��M��G��Q�����ֶ���������Ԫ�أ�ԭ��������������X��Z��Q�ĵ����ڳ����³���̬��Y��ԭ������������������Ӳ�����2����X��Mͬ���壻Z��G�ֱ��ǵؿ��к�����ߵķǽ���Ԫ�غͽ���Ԫ�أ� ��ش��������⣺
��1��Y��Z��M��G����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳���ǣ�дԪ�ط��ţ� ��
��2��Z��Ԫ�����ڱ��е�λ��Ϊ ��
��3������Ԫ�ص�����������Ӧ��ˮ����������ǿ���ǣ�д��ѧʽ�� ��
��4��X��Y���γɶ��ֻ�������мȺ����Լ��ֺ��Ǽ��Լ�������Է���������С�������ǣ�д����ʽ�� �� ��ʵ�����У���ȡ�����ʵķ�Ӧԭ���ǣ�д��ѧ����ʽ�� ��
��5��M2Z�ĵ���ʽΪ �� MX��ˮ��Ӧ�ɷų����壬�÷�Ӧ�Ļ�ѧ����ʽΪ ��
��6�������£�������G�ĵ��ʷ�����Ӧ���ǣ�����ţ� �� a��CuSO4��Һ b��Fe2O3 c��Ũ���� d��NaOH��Һ e��Na2CO3����
��ҵ���õ�ⷨ��G�ĵ��ʵĻ�ѧ����ʽ�� �� ����ʯīΪ�缫�����������Ļ������ijɷ��ǣ�д��ѧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������VSEPRģ���ƶϷ��ӻ����ӵ����幹�͡�
CS2;
AlBr3(���۷���)��
�������ֻ��Է�Ӧ�м�����,���ǵ����о�����1��̼ԭ�Ӻ�3����ԭ�ӡ�����������������������������ģ��,д����Ӧ�Ļ�ѧʽ: ;
;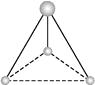 ��
��
�۰�Ҫ��д���ڶ����ڷǽ���Ԫ�ع��ɵ����Է��ӵĻ�ѧʽ��
ƽ���η���,�����η���,�������η�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֻ�ѧ���ʺܻ��õķǽ������ʣ������н�ǿ�������ԡ����������в���ȷ���ǣ��� ��
A.���ȵ�ͭ˿�������о���ȼ�գ������ػ�ɫ��
B.����������ȼ�գ����ɰ�ɫ����
C.�����������������а�����ȼ�գ��ڼ���ƿ���γɰ�ɫ����
D.��������ˮ��Ӧ��������ʹ����ᣬ����������ֽ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com