
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)写出下列溶液中溶质的化学式
A___________,C_______________,E______________,F_________________。
(2)E的浓溶液与Cu应的化学方程式是______________________________________________________;该反应中氧化剂与还原剂的物质的量之比为____________;该反应的还原产物与少量B溶液反应的离子方程式是_____________________________________________________________________________。
(3)如何通过实验进一步确定D溶液的溶质?写出简要的操作及现象_____________________________。
(共9分)(1) NH3·H2O (1分) BaCl2 (1分) H2SO4(1分) AgNO3(1分)
(2)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O (1分) 1:1 (1分)
CuSO4+SO2↑+2H2O (1分) 1:1 (1分)
H2O+2SO2 + CO32-=CO2↑ + 2HSO3―(1分)
(3)取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液(2分)
解析试题分析:纯E为无色油状液体,则E是硫酸。A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾,因此A是氨水。将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解,这说明F中含有Ag+,因此F可能是硝酸银。D中含有Al3+或Mg2+。将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出,说明B应该是碳酸盐。将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶,这说明C应该是氯化钡,D中含有SO42-。
(1)根据以上分析可知,A、C、E、F中溶质的化学式分别为H3·H2O、BaCl2、H2SO4、AgNO3。
(2)浓硫酸具有强氧化性,与铜反应的化学方程式为Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O。该反应中还原剂是铜,化合价从0价升高到+2价。氧化剂是硫酸,S元素化合价从+6价降低到+4价,则根据电子得失守恒可知,氧化剂与还原剂的物质的量之比为1:1;其中还原产物是SO2,由于亚硫酸的酸性强于碳酸的,所以SO2与少量B溶液反应的离子方程式是H2O+2SO2+CO32-=CO2↑+ 2HSO3―。
CuSO4+SO2↑+2H2O。该反应中还原剂是铜,化合价从0价升高到+2价。氧化剂是硫酸,S元素化合价从+6价降低到+4价,则根据电子得失守恒可知,氧化剂与还原剂的物质的量之比为1:1;其中还原产物是SO2,由于亚硫酸的酸性强于碳酸的,所以SO2与少量B溶液反应的离子方程式是H2O+2SO2+CO32-=CO2↑+ 2HSO3―。
(3)要进一步确定D中阳离子,可以利用氢氧化铝的两性进行判断,即取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液。
考点:考查物质的推断、离子检验,氧化还原反应的有关判断与计算等


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:填空题
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为 ,XW的电子式为 ;
(2)Z元素在周期表中的位置是 。
(3)元素U、V、W形成的10电子氢化物中,沸点较低的是 (写化学式);结合H+能力较强的是 (写化学式);用一个离子方程式加以说明 。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为 ,由此可知VW和YW2还原性较强的是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素原子基态电子排布式 。
(2)用电子排布图表示F元素原子的价电子构型 。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为 。
(4)离子半径D+ B3—,第一电离能B C,电负性C F
(填“<”、“>”或“=”)。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比1∶1,X的电子式为 ,试写出Cu、稀H2SO4与X反应制备硫酸铜的离子方程式 。
(6)写出E与D的最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置: ,其原子核外有 种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是 (用元素符号表示)。
(2)ZYQ的电子式是_______________。
(3)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素可组成多种分子,其空间构型可能是 (填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(5)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,请你仅用一个化学方程式表示甲既有氧化性又有还原性:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表所列是元素周期表部分短周期的主族元素
| | W | X | Y | |
| R | | | | Z |
 PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y原子的最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的原子核 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯化钠的电子式是 。
(2)上述反应涉及的元素中,原子半径最大的是 。
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最价氧化物的水化物均能发生反应,该元素是 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
| 时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 | 0.183 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 | 0.687 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
| 950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | ―― |
 NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。查看答案和解析>>
科目:高中化学 来源: 题型:问答题
人民网2012年11月8日西宁电,青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )为原料可生产许多重要的有机物质,电石可由CaO制得(同时还得到一种可燃性气体物质),有关转化关系如下图所示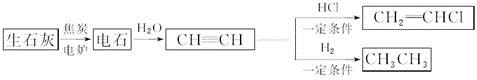
(1)写出制备电石及由电石生成乙炔的化学方程式为__________________、__________________。
(2)基态Ca2+的电子排布式为______________,上面转化关系图中涉及到的元素中,电负性最大的元素是______________,第一电离能最小的元素是________________。
(3)乙炔、乙烷分子中的碳原子杂化类型分别为________________、______________,甲烷的空间构型是________________,该空间构型中,键角__________(填>、<、=)109°28′。
(4)与CH2=CH2相比,CH2=CHCl属于易液化的气体,原因是___________________。
(5)假设下图是电石的晶胞,则一个晶胞中含有________个钙离子,研究表明,亚玲形C的存在,使晶胞沿一个方向拉长,则该晶胞中一个Ca2+周围距离相等且最近的C有________个。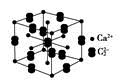
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com