
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O |  | 白色结晶粉末 | 170~ 172℃ | 易溶 于水 |
分析 (1)根据N原子的价层电子对判断其杂化方式,价层电子对=σ键个数+孤电子对个数;
(2)金属元素与非金属元素之间易形成离子键,非金属元素之间易形成共价键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,含有孤电子对的原子和含有空轨道的原子能形成配位键,只有非金属性较强的N、O、F元素能和H元素形成氢键.
解答 解:(1)根据结构简式可知,2个氮原子全部形成单键,属于sp3杂化,另外一个氮原子形成双键,所以是sp2杂化;
故答案为:sp3、sp2杂化;
(2)氯吡苯脲分子中全部是非金属元素构成的,含有共价键,碳、氮,碳、氧,氮、氢,碳、氯等非金属元素之间形成极性共价键,碳碳非金属元素之间形成非极性共价键,另外氮原子和氧原子都含有孤对电子,所以还能形成配位键,只有非金属性较强的N、O、F元素能和H元素形成氢键,所以该物质中不含氢键,
故选BCD.
点评 本题考查杂化类型以及化学键的判断,根据杂化轨道理论以及物质中存在的微粒及微粒间的作用力分析解答,灵活运用概念解答问题,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、OH-、NO3-、HCO3- | ||
| C. | OH-、Ba2+、Na+、AlO2- | D. | Fe3+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的△S<0 | B. | 该反应的△H<0 | ||
| C. | 该反应是不可逆反应 | D. | 该反应产物不会造成大气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.05mol/L | C. | 0.2mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
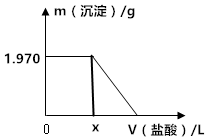 某固体混合物中含有Na2CO3、NaOH、BaCl2.现将3.940g该固体混合物溶于足量水中,结果得到1.970g沉淀;向反应后的试管中逐滴滴加0.5000mol/L的盐酸,加入盐酸的体积和沉淀质量的变化如图所示.
某固体混合物中含有Na2CO3、NaOH、BaCl2.现将3.940g该固体混合物溶于足量水中,结果得到1.970g沉淀;向反应后的试管中逐滴滴加0.5000mol/L的盐酸,加入盐酸的体积和沉淀质量的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)>c(OH-)>c(H+) | D. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①或② | B. | ①或④ | C. | ②或③ | D. | ②或④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com