

分析 (1)苯环上的一溴取代物只有一种,说明苯环上只有一种氢原子;
(2)含有C=C双键的碳链有5个碳原子,双键处于端位置,从C=C双键一端编号,甲基在2号碳原子上.
解答 解:(1)苯环上的一溴取代物只有一种,说明苯环上只有一种氢原子,则2个碳原子不可能是形成1个乙基,只能是2个甲基,且处于对角位置,其结构简式为 ,故答案为:
,故答案为: ;
;
(2)2-甲基-1-戊烯分子中含有C=C双键的碳链有5个碳原子,双键处于端位置,从C=C双键一端编号,甲基处于2号碳原子上,其结构简式为CH2=CH(CH3)CH2CH2CH3,故答案为:CH2=CH(CH3)CH2CH2CH3.
点评 本题考查有机物的命名、有机物结构等,难度中等,注意掌握有机物的命名原则以及等效氢的判断.


科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 6种 | C. | 9种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H<0,△S>0 | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ/mol | |
| C. | 铜分别与浓HNO3、稀HNO3反应,还原产物分别为NO2、NO,所以浓HNO3氧化性小于稀HNO3 | |
| D. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
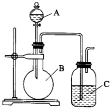 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 0 | 10 | 20 | 30 | 40 |
| S(g/100g水) | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com