
【题目】下列说法正确的是 ( )
A. SO2的摩尔质量为64g
B. 气体的摩尔体积约为22.4L/mol
C. 12g12C中所含碳原子数即为阿伏加德罗常数
D. 4gNaOH溶于1L水所得溶液的物质的量浓度为0.1mol/L
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】有物质的量浓度相同的NaCl 、MgCl2、AlCl3 三种溶液,当溶液的体积比为1:1:1时,三种溶液中Cl- 的物质的量之比为 ( )
A. 1:1:1 B. 1:2:3 C. 3:2:1 D. 3:4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、HCO3﹣、NH4+、Fe3+、Ba2+和K+ , 取该溶液100mL,加入过量NaOH溶液加热,得到0.02mol气体,同时产生1.97g白色沉淀;向上述滤液中加足量BaCl2溶液,也得到1.97g沉淀.由此可知原溶液中( )
A.至少存在5种离子
B.Cl﹣一定存在,且c(Cl﹣)≥0.2mol/L
C.SO42﹣、NH4+、Fe3+一定存在,Al3+、K+、Cl﹣可能存在
D.CO32﹣一定不存在,SO42﹣、NH4+、Fe3+、Cl﹣一定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池的总反应的离子方程式是Zn + Cu2+ = Zn2+ + Cu,该原电池的组成正确的是:
正极 | 负极 | 电解质溶液 | |
A | Zn | Cu | CuCl2 |
B | Ag | Cu | H2SO4 |
C | Cu | Zn | CuSO4 |
D | Cu | Zn | FeCl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制350mL1.0mol/LH2SO4溶液,需用98%的浓硫酸溶液(ρ=1.84g/L)体积为多少?取25mL1.0mol/LH2SO4溶液与2g锌粉充分反应,产生标准状况下H2多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产无铁硫酸铝,以硫酸浸取铝土矿得含铁(Fe2+和Fe3+)的硫酸铝溶液,加热到一定温度,搅拌,加入一定量高锰酸钾溶液和硫酸锰溶液,在溶液中生成活性二氧化锰,调节溶液的pH,反应一段时间,Fe(OH) 3和二氧化锰发生吸附共沉作用,最终得到无铁硫酸铝晶体. 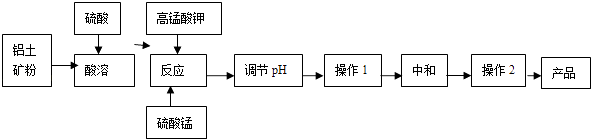
(1)KMnO4首先将Fe2+氧化为Fe3+ , 其本身被还原为MnO2 , 反应的离子方程式为 .
(2)写出高锰酸钾溶液和硫酸锰溶液反应的化学方程式 . 实验证明,n(MnO2)/n(Fe)控制在4:1时,除铁效果较好.若溶液中亚铁离子和铁离子浓度均为0.03mol/L,为达到较好的除铁效果,每1L溶液应加入高锰酸钾的物质的量为 .
(3)调节pH的作用是 .
(4)操作1的名称为 , 操作2的名称为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6molL﹣1的H2SO4溶液中,乙同学将电极放入6molL﹣1的NaOH溶液中,如图所示.
(1)甲中SO42﹣移向极(填“铝片”或“镁片”).写出甲中正极的电极反应式 .
(2)乙中负极为 , 总反应的离子方程式: . 此反应中氧化剂和还原剂的物质的量之比为 .
(3)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法(填“可靠”或“不可靠”).如不可靠,请你提出另一个判断原电池正负极的可行性实验方案(如可靠,此空可不填).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体.相应的实验过程如图:
(1)写出实验过程中所用试剂(写化学式):
试剂①;试剂③ .
(2)判断试剂①已过量的方法是: .
(3)用离子方程式表示加入试剂②的作用:
(4)操作①是利用半透膜进行分离提纯.
操作①的实验结果:淀粉(填“能”或“不能”)透过半透膜;SO42﹣(填“能”或“不能”)透过半透膜.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com