
A、 图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol?L-1 |
B、 图中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时, △H<0,若使用正催化剂,E值会减小 |
C、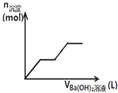 图可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
D、 图表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、氢气的摩尔质量是2 g |
| B、氢气的摩尔质量就是其相对分子质量 |
| C、氢的摩尔质量是2 g/mol |
| D、氢气的摩尔质量是2 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了.全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了.全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.查看答案和解析>>
科目:高中化学 来源: 题型:
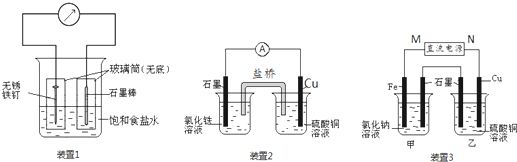
查看答案和解析>>
科目:高中化学 来源: 题型:
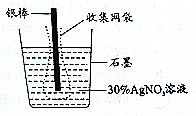 如图是根据电解原理制成的“银电量计”,其原理是:通过测定其电解过程中附着在惰性电极上金属质量,计算通过电解池的电量,下列说法正确的是( )
如图是根据电解原理制成的“银电量计”,其原理是:通过测定其电解过程中附着在惰性电极上金属质量,计算通过电解池的电量,下列说法正确的是( )| A、电量计工作时银棒应与电源的负极相连 |
| B、电量计工作时溶液里的阴离子向阴极移动 |
| C、网袋是收集银溶解过程中产生的金属颗粒,若没有该网袋,测量结果会偏高 |
| D、若得金属银的沉积量108.0mg,则电解过程中转移的电子书为0.002mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-704.6 kJ?mol-1 |
| B、+262.6 kJ?mol-1 |
| C、-131.3 kJ?mol-1 |
| D、+131.3 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
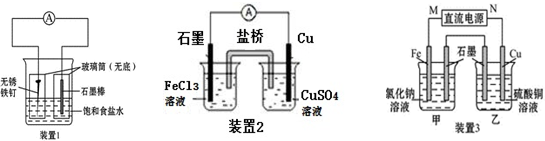
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com