
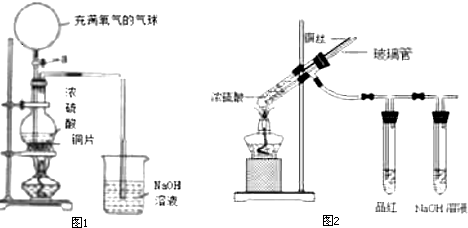
分析 (1)打开活塞a之前,浓硫酸和Cu在加热条件下发生氧化还原反应生成CuSO4、SO2和H2O;打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O;
(2)使用铜丝可以通过与浓硫酸的接触或脱离控制反应;
二氧化硫有毒不能直接排空,通过空气排出装置中二氧化硫;
实验完成后,应将二氧化硫完全排出实验装置,使其完全与NaOH溶液反应;
(3)在整个反应过程中,Cu失去电子数等于SO42-、O2得到的电子数,根据转移电子相等计算生成SO2的物质的量,再根据S原子守恒计算m(Na2SO3).
解答 解:(1)打开活塞a之前,浓硫酸和Cu在加热条件下发生氧化还原反应生成CuSO4、SO2和H2O,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O,反应方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;2Cu+2H2SO4+O2=2CuSO4+2H2O;
(2)可通过上下移动铜丝使之与浓硫酸接触或脱离而控制反应的进行或停止;
二氧化硫有毒不能直接排空,通过玻璃管向装置中通入空气排出装置中二氧化硫,还可以防止倒吸且能指示装置中是否发生堵塞;
实验完成后,为防止污染大气,应先通入足量的空气,排出装置中的二氧化硫,然后再拆卸装置,
故答案为:可通过上下移动铜丝使之与浓硫酸接触或脱离而控制反应的进行或停止;可以防止倒吸、指示后续装置中是否发生堵塞、实验结束时刻通入空气排出装置中二氧化硫从而防止污染;先通入足量的空气,排出装置中的二氧化硫后再拆卸装置;
(3)在整个反应过程中,Cu失去电子数等于SO42-、O2得到的电子数,n(Cu)=$\frac{44.8g}{64g/mol}$=0.7mol,n(O2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,根据转移电子相等n(SO2)=$\frac{0.7mol×2-0.25mol×4}{6-4}$=0.2mol,再根据S原子守恒得n(SO2)=n(Na2SO3)=0.2mol,m(Na2SO3)=0.2mol×126g/mol=25.2g,
故答案为:25.2.
点评 本题以铜和浓硫酸反应实验为载体考查性质实验方案设计,涉及氧化还原反应计算、实验操作、化学方程式的书写等知识点,明确实验原理是解本题关键,难点是确定各个装置作用,易错点是化学用语的正确使用,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 反应物总键能比生成物总键能大 | B. | H-H键断裂 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OH•HCl═4FeCl2+N2O↑+6HCl+H2O
)结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OH•HCl═4FeCl2+N2O↑+6HCl+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,0.02 mol•L-1的醋酸溶液与0.01 mol•L-1的醋酸溶液中的c(H+)之比小于2:1 | |
| B. | 相同温度下,0.1 mol•L-1 (NH4)2SO4溶液与0.1 mol•L-1NH4NO3溶液中c(NH4+)之比大于2:1 | |
| C. | 在0.1 mol•L-1NaOH溶液中逐滴加入0.1 mol•L-1CH3COOH溶液,当溶液pH=7时,加入CH3COOH溶液的体积与NaOH溶液的体积比小于2:1 | |
| D. | 40℃时,pH=7的(NH4)2SO4与NH3•H2O的混合溶液中c(NH4+)与c(SO42-)之比小于2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )
原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )| A. | 两分子原硅酸脱去一分子水得到的H6Si2O7分子中有6个Si-O键 | |
| B. | 两个硅氧四面体,彼此用一个角氧相连后,形成的Si2O76-离子中各键角均为109°28′ | |
| C. | 3个硅氧四面体彼此用3个角氧相连后,形成的Si3O96-离子呈链状 | |
| D. | n个硅氧四面体彼此用四个角氧连接后的晶体是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为负极,Y为正极 | |
| B. | 该电池工作时,X极附近溶液的碱性增强 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 工作一段时间后,KOH的物质的量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H
,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H ,其中含有的化学键类型是离子键和共价键
,其中含有的化学键类型是离子键和共价键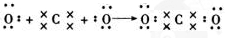 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com