
【题目】钼(Mo)的主要用途是制造特种钢,用CO还原MoO3(白色粉末,加热时变黄)制备单质Mo的装置如图。下列说法正确的是

A.装置②中盛有饱和Na2CO3溶液,装置③中盛有浓硫酸,作用是净化CO2
B.装置①中的稀盐酸可用稀硫酸代替,石灰石可用碳酸钠粉末代替
C.装置④的作用是制备CO,装置⑤的作用是CO还原MoO3
D.装置⑥能达到检验MoO3是否被CO还原的目的
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
A.检验 Na2O2试样是否变质为 Na2CO3:向试样中加入盐酸,产生无色无味的气体
B.检验某卤代烃是否是氯代烃: 试样 ![]() 冷却
冷却![]()
![]() 出现白色沉淀
出现白色沉淀
C.除去溴乙烷中混有的溴:混合液![]()
![]() 溶液分层
溶液分层![]() 得下层
得下层
D.鉴定盐 A 的成分是 FeBr2:
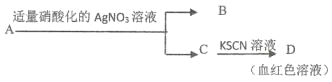
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是指导化学学习的重要工具,下图为元素周期表的一部分,请按要求填空:

(1)N在元素周期表中的位置是______________ ;N和F处于同一行,是由于它们的 __________ 相同。
(2)以上元素中,原子半径最小的是 ________ (写元素符号);最高价氧化物对应水化物中酸性最强的是 ______________ (写化学式)。
(3)Mg和Al中,金属性较强的是 __________ (写元素符号),写出一条能说明该结论的事实_________________________________。
(4) S和Cl中,非金属性较强的是 __________ (写元素符号),不能说明该结论的事实是_________。
a.氯气与铁反应生成 FeCl3,硫与铁反应生成FeS
b.把 Cl2通入 H2S溶液中能发生置换反应
c.受热时 H2S易分解,HCl不易分解
d.单质硫是固体,氯的单质是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大。其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子。D、E为同周期元素且分别位于s区和d区。五种元素所有的s能级电子均为全充满。E的d能级电子数等于A、B、C最高能层的p能级电子数之和。
回答下列问题:
(1)五种元素中,电负性最大的是________(填元素符号)。
(2)E常有+2、+3两种价态,画出E2+的价电子排布图:________________。
(3)与BC互为等电子体的分子、离子分别是______________________(各举1例),BC的结构式为______________(若有配位键,须用“→”表示出来),实验测得该分子的极性极弱,试从结构方面进行解释:________________________________________________。
(4)自然界中,含A的钠盐是一种天然矿藏,其化学式写作Na2A4O7·10H2O,实际上它的结构单元是由2个H3AO3和2个[A(OH)4]-缩合而成的双六元环,应该写成Na2[A4O5(OH)4]·8H2O,其结构式如图1所示,它的阴离子可形成链状结构。
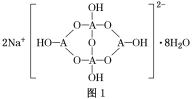
①A原子的杂化方式为________。
②Na2[A4O5(OH)4]·8H2O的阴离子由极性键和配位键构成,请在图中用“→”标出其中的配位键________。该阴离子通过________________相互结合形成链状结构。
③已知H3AO3为一元弱酸,根据上述信息,用离子方程式解释分析H3AO3为一元酸的原因:________________________________________________________________________。
(5)E2+在水溶液中以[E(H2O)6]2+形式存在,向含E2+的溶液中加入氨水,可生成[E(NH3)6]2+,[E(NH3)6]2+更稳定,原因是_____________________________。
(6)由元素B、D组成的某离子化合物的晶胞结构如图2所示,则该物质的电子式为_____。若晶胞的长、宽、高分别为520 pm、520 pm和690 pm,该晶体的密度为________(保留小数点后两位数字)g·cm-3。
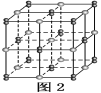
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及 CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
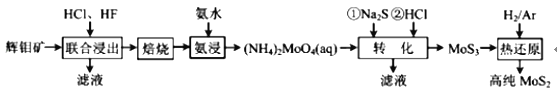
回答下列问题:
(1)(NH4)2MoO4中Mo的化合价为_____。
(2)“联合浸出”中HF除去的杂质化学式为_____,“焙烧”时MoS2转化为MoO3的化学方程式为_____。
(3)“转化”中加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出(NH4)2MoS4与盐酸生成MoS3的离子方程式_____。
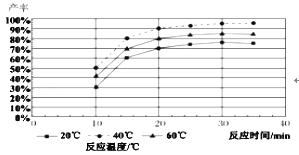
(4)由图分析产生MoS3沉淀的流程中应选择的最优温度和时间是_____,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因_____。
(5)高纯MoS2中存在极微量非整比晶体杂质MoS2.8,则该杂质中Mo4+与Mo6+的物质的量之比为_____。
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的 Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当SO42-完全沉淀时,溶液中c(MoO42-)<_____mol/L(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢作为氢能利用的关键技术,是当前关注的热点之一。一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法错误的是( )
已知:电流效率(η=![]() ×100%)
×100%)
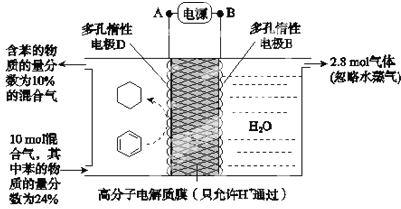
A.电源B为正极
B.导线中电子移动方向为A→D
C.电极D反应式为C6H6+6H++6e-=C6H12
D.该储氢装置的电流效率η=24.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
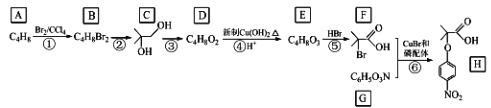
【题目】有机物H属于大位阻醚系列中的一种,在有机化工领域具有十分重要的价值。2018年我国首次使用α﹣溴代羰基化合物合成大位阻醚H,其合成路线如图:
回答下列问题:
(1)A的名称是_____。
(2)H中的官能团名称是_____,①~⑥中属于取代反应的是_____(填序号)。
(3)反应②所需的试剂和条件是_____,③的化学方程式是_____。
(4)化合物X是E的同分异构体,X不能与 NaHCO3溶液反应,能与NaOH溶液反应,又能与金属钠反应。符合上述条件的X的同分异构体有_____种(不考虑立体异构)。其中核磁共振氢谱有3组峰,峰面积之比为1:1:6的结构简式为_____。
(5)请写出以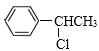 和
和![]() 为原料合成另一种大位阻醚
为原料合成另一种大位阻醚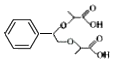 的合成路线:_____。
的合成路线:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图象正确的是( )
A.25℃时,向亚硫酸溶液中通入氯气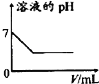
B.向NaAlO2溶液中通入HCl气体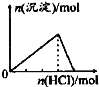
C.向少量氯化铁溶液中加入铁粉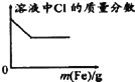
D.向NaOH、Ba(OH)2、NaAlO2的混合液中通入CO2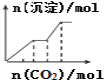
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铵[(NH4)2C2O4] 为无色柱状晶体,不稳定 ,受热易分解,可用于测定 Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。
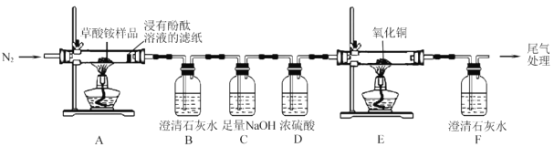
(1)实验过程中,观察到浸有酚酞溶液的滤纸变红,装置 B 中澄清石灰水变浑浊,说明分解产物中含有__________________(填化学式);若观察到__________________,说明分解产物中含有 CO。草酸铵分解的化学方程式为______________________。
(2)反应开始前 ,通入氮气的目的是________________________。
(3)装置 C 的作用是_______________________。
(4)还有一种分解产物在一定条件下也能还原CuO , 该反应的化学方程式为__________。
II.该同学利用草酸铵测定血液中钙元素的含量 。
(5)取 20.00 mL 血液样品 ,定容至 l00m L, 分别取三份体积均为25.00 mL 稀释后的血液样品,加入草酸铵,生成草酸钙沉淀,过滤,将该沉淀溶于过量稀硫酸中,然后用 0.0l00mol/L KMnO4 溶液进行滴定。滴定至终点时的实验现象为___________。三次滴定实验消耗 KMnO4 溶液的体积分别为0.43mL , 0.41 m L , 0.52mL, 则该血液样品中钙元素的含量为________m mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com