
按要求回答:
(1)写出电离方程式:
NaHCO3_______________________________________________________________________
H2S__________________________________________________________________________
(2)写出水解的离子方程式:
Na2CO3________________________________________________________________________
(3)用pH试纸测定0.1 mol·L-1的纯碱溶液的pH,其正确的操作是
__________________________________________________________________________________。
(4)氯化铝水溶液呈 性(填酸性、中性、碱性),原因是(用化学方程式表示):_____________________ _______________________________________________ ______ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(5)实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)Ag+水解。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为
,氨水的浓度a 0.01 mol·L-1(填“>”、“<”或“=”)。
(7)在25℃下,向浓度均为0.20 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 ;当测得溶液pH=11时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)= (已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.0×10-20)
(1)NaHCO3===Na++ HCO3-
H2S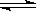 H++HS- HS-
H++HS- HS-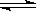 H++S2-(各0.5分,共1分)
H++S2-(各0.5分,共1分)
(2)CO32-+H2O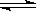 HCO3-+OH- HCO3-+ H2O
HCO3-+OH- HCO3-+ H2O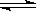 H2CO3+OH-(各0.5分,共1分)
H2CO3+OH-(各0.5分,共1分)
(3)把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较确定溶液的pH
(4)酸 AlCl3+3H2O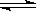 Al(OH)3+3HCl
Fe2O3
Al(OH)3+3HCl
Fe2O3
(5)抑制
(6)OH-、H+、NH4+、Cl- c(Cl-)=c(NH4+)>c(H+)=c(OH-) >
(7)Cu(OH)2 Cu2++2NH3·H2O===Cu(OH)2↓+2NH4+ 9.0×108(2分)
【解析】
试题分析:(1)NaHCO3的电离方程式为:NaHCO3===Na++
HCO3-,(2)H2S是二元弱酸,属弱电解质,分两步电离,第一步电离出氢离子和硫氢根离子,第二步电离:硫氢根离子电离出硫离子和氢离子,故答案为H2S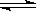 H++HS- HS-
H++HS- HS-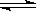 H++S2-;
H++S2-;
(2)Na2CO3的水解的离子方程式为CO32-+H2O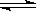 HCO3-+OH- HCO3-+ H2O
HCO3-+OH- HCO3-+ H2O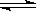 H2CO3+OH-;
H2CO3+OH-;
(3)用pH试纸测定0.1 mol·L-1的纯碱溶液的pH,其正确的操作是把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较确定溶液的pH;
(4)氯化铝为强酸弱碱盐,其水溶液呈酸性,原因是AlCl3+3H2O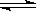 Al(OH)3+3HCl,FeCl3为强酸弱碱盐,其水溶液呈酸性,原因是FeCl3+3H2O
Al(OH)3+3HCl,FeCl3为强酸弱碱盐,其水溶液呈酸性,原因是FeCl3+3H2O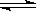 Fe(OH)3+3HCl,加热后Fe(OH)3由于发生分解,所以把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是Fe2O3;
Fe(OH)3+3HCl,加热后Fe(OH)3由于发生分解,所以把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是Fe2O3;
(5)实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制Ag+水解;
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,因为一水合氨为弱碱,所以a大于0.01mol,该溶液含有的离子有OH-、H+、NH4+、Cl-,其浓度由大到小的顺序为c(Cl-)=c(NH4+)>c(H+)=c(OH-) ;
(7)在25℃下,向浓度均为0.20 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2,生成该沉淀的离子方程式为 Cu2++2NH3·H2O===Cu(OH)2↓+2NH4+;
c(Mg2+):c(Cu2+)=Ksp[Mg(OH)2]:Ksp[Cu(OH)2]=9.0×108。
考点:离方程式、离子方程式、盐类水解、溶解度常数
点评:本题考查了离方程式、离子方程式、盐类水解、溶解度常数,本题综合性好,难度适中。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
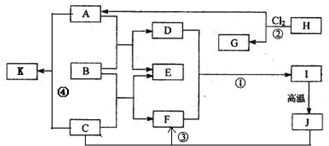


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
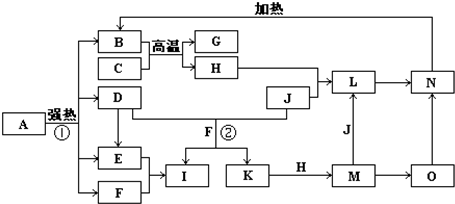
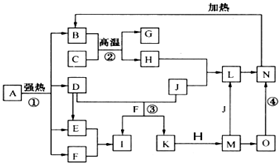 仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)请按要求回答:
仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)请按要求回答:
| ||
. |
| ||
. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验顺序 | 实验内容 | 实验现象 |
| (1) | A+B | 没有现象发生 |
| (2) | B+D | 有气体放出 |
| (3) | B+C | 有沉淀生成 |
| (4) | A+D | 有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
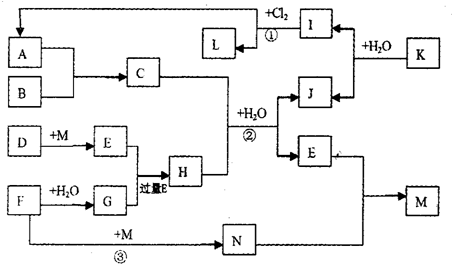
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com