
【题目】反应2NO(g)+O2(g)=2NO2(g)由①、②两步反应构成,其反应进程与能量关系如图,所示。已知:
①NO+O2 =NO3(快反应);②NO3+NO=2NO2(慢反应)。下列说法正确的是
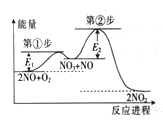
A. NO3比NO稳定
B. ①、②两步反应均为放热反应
C. 第②步的逆反应的活化能更大,因此NO2更容易转化为NO3和NO
D. 升高温度,①、②两步反应速率均加快
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中,正确的是
A. 苯的分子式是C6H6,不能使酸性高锰酸钾溶液褪色,属于饱和烃
B. 从苯的凯库勒式看,分子中含有双键,所以苯属于烯烃
C. 在催化剂作用下,苯与液溴发生取代反应生成溴苯
D. 苯泄露会导致苯溶入水中,渗入土壤,对周边农田、水源造成严重的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)海水淡化后,为检验所得的淡水中是否含有氯离子,通常采用的试剂是
A. AgNO3溶液 B. AgNO3溶液和稀盐酸
C. AgNO3溶液和稀硝酸 D. 以上试剂均可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分子中,都属于含极性键的非极性分子的是( )
A. CO2 H2S B. C2H4 CH4 C. C60 C2H4 D. NH3 HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是( )
A.6与16B.11与17C.14与8D.10与19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的为( )
A. 1s22s22p63s1 B. 1s22s22p63s23p64s1 C. 1s22s22p63s2 D. 1s22s22p63s23p64s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化肥生产中的废催化剂(主要成分为Al2O3、K2O、少量的CoO、SiO2等)来制取明矾的工艺流程如图所示。
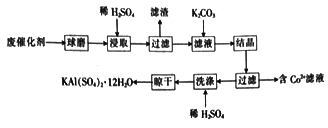
(1)KAl(SO4)2 12H2O中A1的化合价为__________。
(2)废催化剂在浸取前进行球磨的主要目的是______________。
(3)浸取时Al2O3溶解的化学方程式为_________;滤渣的主要成分是______________ (填化学式)。
(4)实验测得K2CO3的加入量与KA1(SO4)2 12H2O产率及纯度关系如下表所示:
编号 | 1 | 2 | 3 | 4 |
K2CO3加入量/g | 2 | 4 | 6 | 8 |
产品质量/g | 3.3 | 5.7 | 4.6 | 4.5 |
明矾纯度/% | 99.1 | 98.2 | 91.4 | 84.9 |
当K2CO3的加入量超过4 g后,晶体的质量减少且纯度降低,其原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应4CO+2NO2![]() N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A. υ(CO)=1.5 mol·L-1·min-1 B. υ(NO2)=0.7 mol·L-1·min-1
C. υ(N2)=0.4 mol·L-1·min-1 D. υ(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),仪器C的名称是 , 本实验所需玻璃仪器E规格和名称是 . 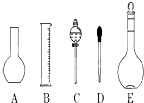
(2)下列操作中,容量瓶所不具备的功能有(填序号).
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶质
D.量取一定体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度0.1mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度0.1mol/L.
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用mL规格的量筒最好.
(5)如果定容时不小心超过刻度线,应如何操作 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com