
�������������������γ��������Ҫ���ʣ�ij�������п��ܺ����������ӣ�Na+��Ba2+��NH4+��Al3+��Cl����SO32����SO42����NO3���ȣ�ij�о�С��ȡ�õ�һ���������꣬Ũ�������ó�����Һ�ֳ�3�ݣ���������ʵ����
���� �����Լ� ʵ������
��һ����Һ �μ������ĵ���KI��Һ ����ɫ
�ڶ�����Һ �μ��������λ���BaCl2��Һ �а�ɫ����
��������Һ �μ���Һ�����ȣ����������������Һ�����V�������ɵij����������������ϵ��n������ͼ�� 
��ش��������⣺
��1������ʵ�����жϸ������п϶������ڵ�������������
д����Һ�еμӵ���KI��Һ��������Ӧ�����ӷ���ʽ������
��3�����ʵ�鷽�����������Һ���Ƿ����Cl��������
��4�����о�С��Ϊ��̽��NO�����������������γɣ�����ƿ�г��뺬������NO��SO2���壬������ͨ��O2��������ѧ��Ӧ����������������ˮ�������������꣬��NO��������Ӧ�е�������������
��5����0.5L�ܱ������ڼ���NO2��SO2��Ϊ�˲ⶨ��ij�ִ��������·�Ӧ��NO2��g��+SO2��g��⇌NO��g��+SO3��g���ķ�Ӧ���ʣ���t0C�����崫������ò�ͬʱ���NO2��SO2Ũ����������������¶ȱ仯�Դ�����Ч�ʵ�Ӱ�죩��
ʱ��/s 0 1 2 3 4 5
c��NO2��/mol•L��1 1.00��10��3 4.50��10��4 2.50��10��4 1.50��10��4 1.00��10��4 1.00��10��4
c��SO2��/mol•L��1 3.60��10��3 3.05��10��3 2.85��10��3 2.75��10��3 2.70��10��3 2.70��10��3
��ǰ2s��NO��ƽ����Ӧ����v��NO��=����
��t��÷�Ӧ�Ļ�ѧƽ�ⳣ��K=������
���㣺 �������ӵļ��鷽������Ӧ���ʵĶ�����ʾ��������ѧƽ�ⳣ���ĺ��壮
ר�⣺ ���ӷ�Ӧר�⣻��ѧƽ��ר�⣮
������ ��1���������ӹ����֪ʶ��ȷ����Һ�е����ӵĴ��������Ȼ��ȷ����Һ��һ�������ڵ����ӣ�
���ݵ��ʵ���ʹ����KI��Һ����ɫ��������
��3�����������ӵļ��鷽�����������ữ����������������ɫ��������Ҫ�ų�������ĸ��ţ�
��4���������ʵ���������д����ʽ������һ�������ڷ�Ӧ�е��ص����ж��������ã�
��5���ٸ��ݱ������ݼ����һ��������Ũ�ȣ��ٸ���v= �����ǰ2s��NO��ƽ����Ӧ���ʣ�
�����ǰ2s��NO��ƽ����Ӧ���ʣ�
�ڸ��ݻ�ѧƽ�ⳣ���Ʊ���ʽ��ϱ��дﵽƽ��״̬����ֵ�Ũ�����t��÷�Ӧ�Ļ�ѧƽ�ⳣ����
��� �⣺��1���μ������ĵ���KI��Һ������ɫ��˵���ڸ�������Һ����һ���ܽ�����������Ϊ�ⵥ�ʵ����Ӵ��ڣ�������������ֻ��NO3������һ������NO3������һ�����Ậ��SO32������ΪSO32�����н�ǿ�Ļ�ԭ�ԣ����������£���NO3�����ܹ��棻�μ��������ữ��BaCl2��Һ���а�ɫ������������һ������SO42����һ������Ba2+���μ�NaOH��Һ�����ȣ�������������ʹʪ��ĺ�ɫʯ����ֽ���������а������ɣ���һ������NH4+����������������Һ���г���������ֱ����ʧ��һ����Al3+���������ӡ������ӵĴ���������жϣ�
����һ�����ڵ�����Ϊ��NO3����SO42����Al3+��NH4+��һ�������ڵ�����Ϊ��SO32����Ba2+������ȷ�������ӣ�Na+��Cl����
�ʴ�Ϊ��SO32����Ba2+��
������������ԣ��ܹ����������ӣ���Ӧ�����ӷ���ʽΪ��6I��+2NO3��+8H+=3I2+2NO��+4H2O��
�ʴ�Ϊ��6I��+2NO3��+8H+=3I2+2NO��+4H2O��
��3�������ӵļ��鷽��Ϊ���������ữ����������������ɫ��������Ҫ�ų�������ĸ��ţ�
�ʴ�Ϊ��ȡ������Һ���μ�������Ba��NO3��2��Һ�����ã�ȡ�ϲ���Һ���μ������ữ��AgNO3��Һ�����а�ɫ���������������Cl����
��4��һ���������л�ԭ�ԣ������ױ���������������ʽΪ��2NO+O2=2NO2�����������ܽ�������������������ʽΪNO2+SO2=SO3+NO����������һ������������û�б仯�����ڷ�Ӧ����������
�ʴ�Ϊ��������
��5����ǰ2s�ڣ�����������Ũ�ȱ仯Ϊ����1.00��10��3��2.50��10��4��mol/L=7.50��10��4mol/L����Ӧ���ɵ�һ������Ũ��Ϊ��7.50��10��4mol/L��
ǰ2s��NO��ƽ����Ӧ����v��NO��=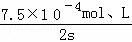 =3.75��10��4mol•L��1•s��1��
=3.75��10��4mol•L��1•s��1��
�ʴ�Ϊ��3.75��10��4mol•L��1•s��1��
�ڸ��ݱ������ݿ�֪��4s��Ӧ�ﵽƽ��״̬������ֵ�Ũ��Ϊ��c��NO2��=1.00��10��4mol/L��c��SO2��=2.7��10��3mol/L��һ�����������������Ũ����ȣ��ҵ��ڶ������ĵ�Ũ�ȱ仯��������c��NO��=c��SO3��=��1.00��10��3��1.00��10��4��=9.0��10��4mol/L��
t��÷�Ӧ�Ļ�ѧƽ�ⳣ��K=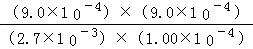 =3��
=3��
�ʴ�Ϊ��3��
������ ���⿼���������ƶϡ���ѧ��Ӧ���ʡ���ѧƽ�ⳣ���ļ����֪ʶ����Ŀ�Ѷ��еȣ������������ڿ��Ե��ȵ���ѵ㣬����������ѧ�������������������ѧ��������û���֪ʶ���ʵ�������������
��


 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
C6H14�ĸ���ͬ���칹���У���ʹ��һ��ȡ������Ŀ���٣���ṹ�������ļ���Ϊ��������
| �� | A�� | 1�� | B�� | 2�� | C�� | 3�� | D�� | 4�� |
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��B��һ�������¿ɺϳɷ����廯����E��G�ڱ�״���������壬������µ��ܶ�Ϊ1.25g/L�������ʼ��ת����ϵ������ʾ��
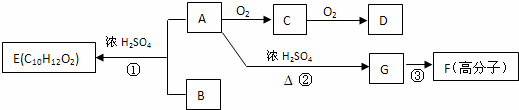
��ش��������⣺
��1��G�еĹ��������������û�ѧʽ��ʾ����D�еĹ�����������������F�Ľṹ��ʽ������
��2��ָ����Ӧ���ͣ�������������������������
��3����������������B��ͬ���칹���������֣�
����FeCl3��Һ����ɫ ���ܷ���������Ӧ �۱�����ֻ������ȡ����
��4��д����ѧ����ʽ��A��C������
C�����Ƶ�������ͭ����Һ��Ӧ��������
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ����Fe2+��Na+��Al3+��Ba2+��SO42����NO3����Cl���е�4�����ӣ��������ӵ����ʵ�����Ϊ1mol���������Һ�м��������ϡ���ᣬ���������������Һ������������䣨������ˮ�ĵ�������ӵ�ˮ�⣩������˵������ȷ���ǣ�������
�� A�� ����Һ�������������ǣ�Fe2+��Na+��SO42����NO3��
�� B�� �������Һ�м��������ϡ���ᣬ�����������ڿ������ܱ�ɺ���ɫ
�� C�� �������Һ�м��˹�����ϡ�����KSCN��Һ����Һ��Ѫ��ɫ
�� D�� �������Һ�м���������NaOH��Һ����ַ�Ӧ���ˡ�ϴ�ӡ����գ��������ù��������Ϊ72g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ�������������еļ��֣��������������ӵ����ʵ���Ũ�Ⱦ�Ϊ0��lmol/L������ˮ�ĵ��뼰���ӵ�ˮ�⣩��K+ Ag+ Mg2+ Al3+ NH4+ Cl�� CO32�� NO3�� SO42�� I��
�����¸���ʵ���������Һ��ɣ�
��ȡ5mL��Һ��������ϡ��ˮ��������Һ���г������ɣ��������������ӣ�
���ò�˿պȡ��Һ���ڻ��������գ�����ɫ�겣���۲죬���治����ɫ��
����ȡ��Һ����������ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ��
�������ʵ�����õ���Һ�м���BaCl2��Һ���а�ɫ�������ɣ�
��ش��������⣺
��1���ɲ�����жϣ���Һ��һ�������е��������������������������ɫ����Ļ�ѧʽ������
����ȷ����Һ��������������������
��3����ȡ100mLԭ��Һ������������NaOH��Һ����ַ�Ӧ����ˣ�ϴ�ӣ����ճ��������أ��õ��Ĺ��廯ѧʽΪ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
CaCO3��ϡ���ᷴӦ�����ȷ�Ӧ������CO2�����뷴Ӧʱ��Ĺ�ϵ��ͼ�����н�����ȷ���ǣ���
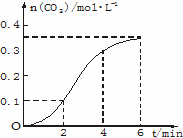
A�� ��Ӧ��ʼ4 min���¶ȶԷ�Ӧ���ʵ�Ӱ���Ũ��С
B�� ��Ӧ4 min��ƽ����Ӧ������С
C�� ��Ӧ��ʼ2 min��ƽ����Ӧ�������
D�� ��Ӧ�ڵ�2 min����4 min������CO2��ƽ����Ӧ����Ϊ v��CO2��=0.1 mo1•��L•min��﹣1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�Ի�ѧƽ���뻯ѧ��Ӧ���ʵĹ� ϵ��֪����
ϵ��֪����
A�� ��ѧ��Ӧ���ʱ仯ʱ����ѧƽ��һ�������ƶ�
B�� ��ѧƽ�ⷢ���ƶ�ʱ����ѧ��Ӧ����һ���仯
C�� ����Ӧ���еij̶ȴ�����Ӧ����һ����
D�� ֻ��ʹ�ô����Żᷢ����ѧ��Ӧ���ʱ仯������ѧƽ�ⲻ�ƶ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij����ʽΪC10H20O2��������һ�������¿ɷ�������ͼ��ʾ��ת�����̣�������������������Ľṹ����(����)
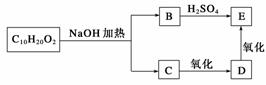
A��2�� B��4�� C��6�� D��8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ͬ�������ܱ������зֱ����O2��O3���壬���������������¶Ⱥ������ܶ����ʱ������˵����ȷ����( )
A�����������ѹǿ��� B��O2��O3����С
C����������ķ�����Ŀ��� D�������������ԭ����Ŀ���
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com