
分析 2-丁烯中含有碳碳双键,2-丁烯和溴发生加成反应生成2,3-二溴丁烷,2,3-二溴丁烷在氢氧化钠水溶液中水解生成2,3-丁二醇.
解答 解:2-丁烯中含有碳碳双键,2-丁烯和溴单质加成反应生成2,3-二溴丁烷,反应方程式为:CH3-CH=CH-CH3+Br2→CH3-CHBr-CHBr-CH3,卤代烃在氢氧化钠的水溶液中水解生成醇,所以2,3-二溴丁烷在氢氧化钠水溶液中水解,反应方程式为:CH3-CHBr-CHBr-CH3+2NaOH$\stackrel{△}{→}$CH3CHOHCHOHCH3+2NaBr,制得2,3-丁二醇.
故答案为:CH3-CH=CH-CH3+Br2→CH3-CHBr-CHBr-CH3、CH3-CHBr-CHBr-CH3+2NaOH$\stackrel{△}{→}$CH3CHOHCHOHCH3+2NaBr.
点评 本题考查了有机物合成,侧重考查物质性质的分析应用,主要是烯烃加成反应和官能团引入的方法分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
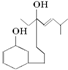 下列说法中正确的是( )
下列说法中正确的是( )| A. | 该有机物的分子式为C17H29O2 | B. | 分子中有苯环 | ||
| C. | 能够使高锰酸钾溶液褪色 | D. | 只有一个官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫具有还原性,能与强氧化性的高锰酸钾发生氧化还原反应 | |
| B. | 因为二氧化硫具有漂白性,能使品红溶液永久褪色 | |
| C. | 大气中二氧化碳浓度高时能形成酸雨 | |
| D. | 浓硫酸常用作干燥剂,因为浓硫酸具有脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C5H12O的醇 | ||
| C. | 分子式为C5H10O2的羧酸 | D. | 分子式为C5H10O2的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8或C5H8 | B. | C3H8或C5H8 | C. | C4H8或C3H8 | D. | C5H8或C6H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 25℃时,$\frac{c(HX)}{c({X}^{-})•c({H}^{+})}$=109.3 | |
| B. | M点溶液中存在:c(X-)+c(OH-)=c(H+)+c(Na+) | |
| C. | 滴加盐酸的过程中,水的电离程度先减小后增大 | |
| D. | 常温下,等浓度等体积的HX和NaX溶液混合后,溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫的接触氧化在合成塔中发生 | |
| B. | 吸收塔得到的硫酸浓度为98% | |
| C. | 煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% | |
| D. | 接触室中适宜条件是V2O5作催化剂、高温、常压 | |
| E. | 接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.
NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com