
����Ŀ����һ��2L���ܱ������У�������Ӧ2SO3��g��2SO2��g��+O2��g������H��0������SO3�ı仯��ͼ��ʾ�� 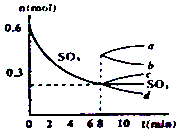
��1����O2��ʾ0��8min�ڸ÷�Ӧ��ƽ������v= ��
��2�������¶ȣ�Kֵ���������������ƽ����Է��������� �� ���������С�����䡱��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����
a��v��SO3��=2v��O2�� b��������ѹǿ���ֲ���
c��v����SO2��=2v����O2�� d���������ܶȱ��ֲ���
��4����8min��ѹ������Ϊ1L����SO3�ı仯����Ϊ
A.a
B.b
C.c
D.d��
���𰸡�
��1��0.0125 mol/��L?min��
��2������С
��3��bc
��4��A
���������⣺��1����ͼ��֪��0��8min��SO3����0.6mol��0.2mol=0.4mol��v��SO3��= ![]() =0.025 mol/��Lmin�����������֮�ȵ��ڻ�ѧ������֮�ȼ�����O2��ʾ0��8min�ڸ÷�Ӧ��ƽ������v=0.025 mol/��Lmin����
=0.025 mol/��Lmin�����������֮�ȵ��ڻ�ѧ������֮�ȼ�����O2��ʾ0��8min�ڸ÷�Ӧ��ƽ������v=0.025 mol/��Lmin���� ![]() =0.0125 mol/��Lmin�������Դ��ǣ�0.0125 mol/��Lmin������2���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���K����ƽ�������ƶ���������������䣬����������ʵ��������������������ƽ����Է�����������С�����Դ��ǣ�����С����3��a��v��SO3��=2v��O2��������ȷ�����淴Ӧ���ʵĹ�ϵ�������ж�ƽ�⣬�ʲ�ѡ��
=0.0125 mol/��Lmin�������Դ��ǣ�0.0125 mol/��Lmin������2���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���K����ƽ�������ƶ���������������䣬����������ʵ��������������������ƽ����Է�����������С�����Դ��ǣ�����С����3��a��v��SO3��=2v��O2��������ȷ�����淴Ӧ���ʵĹ�ϵ�������ж�ƽ�⣬�ʲ�ѡ��
b���÷�ӦΪǰ������������ȵķ�Ӧ����������ѹǿ���ֲ��䣬�ﵽƽ��״̬����ѡ��
c��v����SO2��=2v����O2������֪���淴Ӧ������ȣ�Ϊƽ��״̬����ѡ��
d��������������䣬���������ܶ�ʼ�ձ��ֲ��䣬�����ж�ƽ�⣬�ʲ�ѡ��
���Դ��ǣ�b c����4����8min��ѹ������Ϊ1L��˲�����������������ƽ�������ƶ����������������������С��0.6mol��ֻ��a���ϣ����Դ��ǣ�a��
�����㾫�������û�ѧƽ��ļ������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�ʫ�������ij����з����Ļ�ѧ��Ӧ������������ԭ��Ӧ���ǣ���
A. ��������һ��������ڻ�ҩ���ȱ�ը
B. ����ɻ���ʼ������ʯ����ȼ��
C. ¯������أ�������������������ұ��
D. ������ǻ벻��������״����ʯ���Ƴɹ�����ʹ�õķ�ĩ״����ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʹ�õĽ���֮һ��������ѧ֪ʶ���ش��������⡣
��1������Fe(OH)3�����FeCl3��Һ�ķ�����_____________________________��
��2����һ������������Ʒ����5mol/L����140mLǡ����ȫ�ܽ⣬������Һ�������ձ����560mL������Fe2+ȫ�����Fe3+�������Ʒ��Fe ��O �ĸ�����Ϊ_____________��
��3��ij�о���ѧϰС����Fe2(SO4)3��Һ��ʴ��Ե���ϵ�ͭ������ӡˢ��·����Ϊ�ⶨFe2(SO4)3��ʴͭ��������Һ����ɣ�����������ʵ�飺
��ȡ����������Һ������KSCN��Һ�ʺ�ɫ����ɼ������Һ�к��еĽ�����������_____��
����֤����Һ�к���Fe2+����ȷ��ʵ�鷽����__________������ĸ�������
A���۲���Һ�Ƿ��dz��ɫ
B��ȡ������Һ���������Ը��������Һ������ɫ��֤������Fe2+
C��ȡ������Һ��������ˮ���ٵ���KSCN��Һ������Ѫ��ɫ��֤��ԭ��Һ�к���Fe2+
��4������ʦ��������ӡˢ��·��ķ�ˮ�л���ͭ�������FeCl3��Һ��������·�����
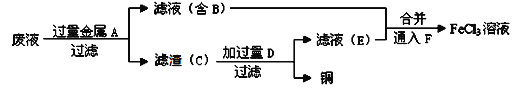
������C����Ҫ�ɷֵĻ�ѧʽΪ___________________________________��
�ڼӹ���D������Ӧ�����ӷ���Ϊ__________________________________��
��ͨ��F������Ӧ�Ļ�ѧ����ʽΪ __________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.52gͭþ�Ͻ���ȫ�ܽ���50mL�ܶ�Ϊ1.40g/mL����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1120mL(��״��}����Ӧ�����Һ�м���1.0mol/LNaOH��Һ������������ȫ������ʱ���õ�2.54g����������˵������ȷ����
A. �úϽ���ͭ���������ʵ���֮����2��1
B. ��Ũ������HNO3�����ʵ���Ũ����14.0mol/L
C. �õ�2.54g����ʱ������NaOH��Һ�������600mL
D. NO2��N2O4�Ļ�������У�NO2�����������80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������Һ���й���������ȷ���ǣ� ��
�� | �� | �� | �� | |
pH | 11 | 11 | 3 | 3 |
��Һ | ��ˮ | NaOH��Һ | ���� | ���� |
A.�ֱ��ˮϡ��10����������Һ��pH�٣��ڣ��ܣ���
B.�ټ����������Ȼ�茶������Һ��pH��С
C.����Һ��c��NH4+��+c��H+�����ڢ��е�c��Cl����+c��OH����
D.VaL����VbL����Һ��Ϻ�����Ϻ���ҺPH=4����Va��Vb=11��9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ʵ���Ũ�ȵ����ᡢ����������Һ�ֱ���ڼס������ձ��У���������������������������������Ϊ5:6����ס������ձ��еķ�Ӧ������ֱܷ���
A. �ס����ж��������� B. ���������������м����
C. ��������������������� D. �����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������������Ʒ����5 mol/L����140 mLǡ����ȫ�ܽ⣬������Һ�������ձ�״����0.56 L������ʹ����Fe2+ȫ��ת��ΪFe3+������Ʒ���ܵĻ�ѧʽ��
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������ȡ���κ����±(��Ҫ�ɷ�ΪNaCl)�Ʊ�����þ���乤���������£�����˵���У��������
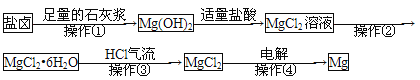
A. ����ʵ���ҽ��в�����ֻ��Ҫ©�����ձ����ֲ�������
B. ������������Ũ�������½ᾧ���ˡ�ϴ�ӵȲ���
C. ������ͨ��HCl������Ϊ������MgCl2��ˮ��
D. �������Ʊ������У�δ�����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��ʯ���ѽ�������Ҫ�ɷ֣������ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����һ�������£�������ת����

��1����ϩ�ĵ���ʽ��___________________��
��2��������������ϩ���ѽⷴӦ����_________________�����ѧ�������������仯��
��3����ϩת��Ϊ�Ҵ��ķ�Ӧ������__________________��
��4���Ҵ�ת��ΪA�Ļ�ѧ����ʽ��____________________________________________��
��5����ҵ����ϩͨ���ۺϷ�Ӧ�ɵõ��߷��ӻ�����B����Ӧ�Ļ�ѧ����ʽ��_____________________________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com