
【题目】贝诺酯是解热镇痛抗炎药,其结构如图所示。下列有关说法正确的是

A. 分子式为C17H14O5N
B. 贝诺酯能发生银镜反应
C. 1 mol贝诺酯与H2发生加成反应最多消耗8mol H2
D. 在氢氧化钠水溶液中水解可以得到3种有机物钠盐
科目:高中化学 来源: 题型:
【题目】元素W、X、Y、Z的原子序数依次增加。p、q、r是由这些元素组成的二元化合物。m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01 mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体。上述物质的转化关系如图所示。下列说法错误的是

A. q的溶液显酸性
B. W的氧化物常温常压下为液态
C. p不能使酸性高锰酸钾溶液褪色
D. Z的氧化物的水化物一定为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向0.01 mol/L的醋酸溶液中,滴入1.00 mol/L、pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化如图所示。下列分析正确的是

A. a点,pH=2
B. b点,c(CH3COO-)>c(NH![]() )
)
C. c点,pH可能大于7
D. ab段,醋酸溶液的稀释是溶液pH增大的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应所得产物一定不存在同分异构体的是
A. 异戊二烯与(![]() )等物质的量的Br2反应
)等物质的量的Br2反应
B. 2-氯丁烷与(![]() )NaOH乙醇溶液共热
)NaOH乙醇溶液共热
C. 甲苯与Cl2在一定条件下发生取代反应
D. 邻羟基苯甲酸(![]() )与NaHCO3溶液反应
)与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的主要组成元素是碳、氢、氧、硫、氮,还有极少量的磷、砷、锗、镓、铟等元素, 燃煤产生CxHy、SO2、NOX等大气污染物,研究NO2、NO、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)锗是第四周期第ⅣA元素,其原子结构示意图为_______________。
(2)利用煤的气化获得的水煤气(主要成分为CO、CO2和H2)在催化剂作用下可以合成绿色燃料甲醇。
已知:H2O(l)=H2O(g) △H1=+44.0kJ/mol
CO2(g)+H2(g)=CO(g)+H2O(l) △H2=-3.0 kJ/mol
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-58.7 kJ/mol
写出由CO与H2制备CH3OH气体的热化学方程式_________________。
(3)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3,简称DMC):
2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g) △H4<0
CH3OCOOCH3(g)+H2O(g) △H4<0
①该化学反应的平衡常数表达式为K=________________。
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是_______(填标号)。
A.v正(CH3OH)= 2v逆(H2O) B.容器内气体的密度不变
C.容器内压强不变 D.CH3OH与CO2的物质的量之比保持不变
③一定条件下分别向甲、乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如下表,反应过程中DMC的物质的量浓度随时间变化如下图所示:


甲容器中,在5-15min中的平均反应速率v(CO2) =__________。乙容器中,若平衡时n(CO2) =0.2mol,则T1__________T2(填“>”“<"或”=”)。甲、丙两容器的反应达平衡时CO2的转化率:甲__________丙(填“>”“<"或”=”)。
(4)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(ⅰ)与溶液pH的关系如图所示。

①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是__________________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1000molL-1NaOH溶液滴定20.00mL0.1000molL-1H2SO3溶液过程中的pH变化如图所示。下列说法错误的是
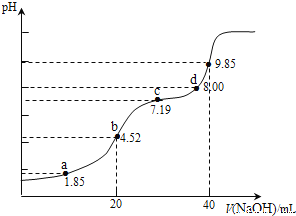
A. a点所得溶液中:3c(H2SO3)+3c(HSO3-)+3c(SO32-)=0.2000molL-1
B. b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c点所得溶液中:c(SO32-)=c(HSO3)
D. d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电化学原理还原CO2制取ZnC2O4的装置如图所示(电解液不参加反应),下列说法正确的是

A. 可用H2SO4溶液作电解液
B. 阳离子交換膜的主要作用是増強导电性
C. Pb电极的电极反应式是2CO2-2e-==C2O42-
D. 工作电路中毎流过0.02mol电子,Zn电极质量减重0.65g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下图中氮元素及其化合物的转化关系,回答问题:
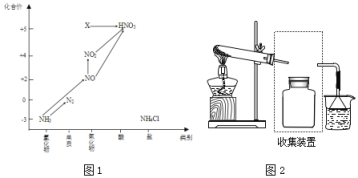
(1)图1中,X的化学式为___,从化合价上看,X具有___性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________。
②下列试剂不能用于干燥NH3的是___(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图___。
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式__________________________ 。
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:___________________
②NO和NO2按一定比例混合可以被NaOH溶液完全吸收,写出相关化学方程式_____________。
工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
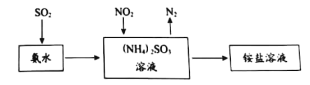
NO2被吸收过程的离子方程式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com