
【题目】乙炔广泛用于焊接、焊割及有机合成等方面。
(1)已知下列热化学方程式:
4CH4 (g)+3O2(g)==2C2H2(g)+6H2O(g) △H1=a kJmol-1;
2H2(g)+O2(g)==2H2O(g) △H2=b kJmol-1;
2CH4(g)==C2H2(g)+3H2 (g) △H3
①△H3=____________________ (用含a、b的代数式表示)kJmol-1。
②已知下列共价健的键能数据:
共价键 | C—H | H—H | C |
键能/ kJmol-1 | 413.4 | 436 | 812 |
则△H3=____________________ (填数值)kJmol-1。
(2)氯仿(CHCl3)与金属银共热可以制取乙炔,该反应的化学方程式为__________________________。
(3)向压强为1.0×104 kPa的恒压密闭容器中充入1 mol乙炔和1 mol HC1气体,在催化剂作用下乙炔与HC1发生反应:HC![]() CH(g)+HCl(g)
CH(g)+HCl(g)![]() CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。
CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。

①该反应的△H__________(填“>”或“<”)0,N点时乙炔的反应速率v(正)________(填“>”或“<” 或“=”) v(逆)。
② M点对应温度下,该反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(kPa)-1,
【答案】 ![]() +360.4 2CHCl3+6Ag
+360.4 2CHCl3+6Ag![]() HC
HC![]() CH↑+6AgCl < > 2.4×l0-3
CH↑+6AgCl < > 2.4×l0-3
【解析】(1)考查盖斯定律的应用以及反应热与键能的关系,①:①4CH4 (g)+3O2(g)=2C2H2(g)+6H2O(g),②2H2(g)+O2(g)=2H2O(g),
因此有(①-②×3)/2,即△H3=(a-3b)/2kJ·mol-1;②△H=反应物键能总和-生成物键能总和=2×4×413.4-(2×413.4+812+3×436)kJ·mol-1=+360.4kJ·mol-1;(2)考查化学反应方程式的书写,氯仿和金属银反应生成乙炔和氯化银,因此方程式为2CHCl3+6Ag![]() HC
HC![]() CH↑+6AgCl;(3)考查勒夏特列原理、化学平衡的计算,①根据图像,随着温度的升高,乙炔的平衡转化率降低,说明升高温度,平衡向逆反应方向移动,即正反应方向是放热反应,△H<0,此线为平衡线,平衡线上的每一个点达到平衡,N→M,乙炔转化率增大,即平衡向正反应方向进行,正反应方向速率大于逆反应方向速率;②
CH↑+6AgCl;(3)考查勒夏特列原理、化学平衡的计算,①根据图像,随着温度的升高,乙炔的平衡转化率降低,说明升高温度,平衡向逆反应方向移动,即正反应方向是放热反应,△H<0,此线为平衡线,平衡线上的每一个点达到平衡,N→M,乙炔转化率增大,即平衡向正反应方向进行,正反应方向速率大于逆反应方向速率;②
HC![]() CH(g)+HCl(g)
CH(g)+HCl(g)![]() CH2=CHCl(g)
CH2=CHCl(g)
起始: 1 1 0
变化: 0.8 0.8 0.8
平衡: 0.2 0.2 0.8,乙炔平衡时物质的量分数为0.2/1.2,氯化氢的物质的量分数为0.2/1.2,氯乙烯的物质的量分数为0.8/1.2,Kp=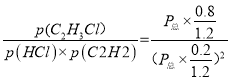 ,代入数值,解得Kp=2.4×10-3。
,代入数值,解得Kp=2.4×10-3。


科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是
A. K+、H+、SiO32-、SO42-
B. Na+、K+、OH-、SO32-
C. Na+、Cl-、H+、ClO-
D. Fe2+、Na+、AlO2-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)。

(1)若X的摩尔质量是W的2倍,工业上Z可作优质的耐高温材料。W为黑色固体,则Y 的化学式________________。
(2)若固体W是紫红色,且向溶液Z中滴入氯水,再滴入2滴KSCN溶液,溶液呈血红色。则写出X+Y=Z+W 的离子方程式__________________________。
(3)若晶体W是一种重要的半导体材料,实验室可用澄清石灰水来检验Z的燃烧产物。写出Y与NaOH溶液反应的化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的日常生活中离不开合金,下列物质中不属于合金的是( )
A. 用于门窗框架上的硬铝 B. 用于冶炼金属铁的赤铁矿
C. 用于生产铁锅的生铁 D. 用于制造手术刀的不锈钢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在市场上洗衣粉多为加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质油渍遇到它,皆能水解而除去,下列衣料中不能用加酶洗衣粉洗涤的是 ( )
A. 棉织品 B. 毛织品 C. 晴纶织品 D. 人造丝绸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中出现了“增铁酱油”、“高钙奶粉”、“富硒茶叶”、“含氟牙膏”、“加碘食盐”等商品。这里的铁、钙、硒、氟、碘应理解为 ( )
A. 单质 B. 分子 C. 氧化物 D. 元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应过程中转移的电子为( )
A. 0.08 mol B. 0.16 mol C. 0.24 mol D. 0.32mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验:

已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
(3)硅酸不溶于水
(4)固体C为Al2O3
请回答下列问题:
(1)固体A在潮湿的空气中久置可能会发生一个明显的变化,这个变化是 ;发生反应的化学方程式为 ;
(2)步骤③中洗涤沉淀的实验操作为 ;
(3)该样品中铝的质量分数是 (用a、b表示);
(4)下列因操作不当,会使测定结果偏大的是 ;
A.第③步中沉淀未用蒸馏水洗涤
B.第①步中加入NaOH溶液不足
C.第④步对沉淀灼烧不充分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)湿法制备高铁酸钠(Na2FeO4)的反应体系有六种微粒:Fe(OH)3、ClO-、OH-、FeO![]() 、
、
Cl-、H2O。
①写出并配平湿法制备高铁酸钠的离子方程式:__________________________。
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),最可能的原因是_________________________________________________________________。
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是________________,氧化产物是____________,每生成1 mol Na2FeO4转移________mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com