
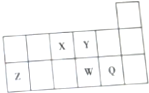
| A. | X的最高价氧化物对应水化物能与它的氢化物反应 | |
| B. | Y原子的电子总数是其K层电子数的3倍 | |
| C. | Z的氧化物能溶于氢氧化钠溶液 | |
| D. | Q的单质能与W的氢化物发生置换反应 |
分析 由短周期元素X,Y,Z,W,Q在元素周期表中的相应位置,可知X为N、Y为O、Z为Al、W为S、Q为Cl.
A.X的最高价氧化物对应水化物为硝酸,它的氢化物为氨气,二者反应生成硝酸铵;
B.Y为O元素,原子核外电子数为8;
C.Z的氧化物为氧化铝,能与氢氧化钠溶液反应;
D.氯气能与硫化氢反应生成硫与硫化氢.
解答 解:由短周期元素X,Y,Z,W,Q在元素周期表中的相应位置,可知X为N、Y为O、Z为Al、W为S、Q为Cl.
A.X的最高价氧化物对应水化物为硝酸,它的氢化物为氨气,二者反应生成硝酸铵,故A正确;
B.Y为O元素,原子核外电子数为8,电子总数是其K层电子数的4倍,故B错误;
C.Z的氧化物为氧化铝,能与氢氧化钠溶液反应生成偏铝酸钠与水,溶于氢氧化钠溶液,故C正确;
D.氯气能与硫化氢反应生成硫与硫化氢,属于置换反应,故D正确,
故选B.
点评 本题考查元素周期表应用,难度不大,侧重对元素化合物知识的考查,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 讲盛满氯气的试管倒扣在水槽中,放在日光下静置一段时间 | 气体逐渐减少,最后变为无色 | Cl2置换出水中的氧生成了O2 |
| B | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向饱和Na2CO3溶液中通入足量的CO2 | 溶液变浑浊 | 溶解度:NaHCO3<Na2CO3 |
| D | 向氯水中滴加紫色石蕊试剂 | 溶液变红 | 氯水显酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
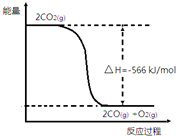 已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 如图可表示①反应过程中的能量变化 | |
| C. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509kJ•mol-1 | |
| D. | 由②可知,反应生成Na2CO3固体106g,放出热量226kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| B. | 实验室点燃H2前,应先检验气体纯度 | |
| C. | 氯水与亚硫酸钠溶液的混合液,漂白性更强 | |
| D. | 不慎将浓硫酸沾到皮肤上,立即用大量水冲洗,然后涂上烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4,M元素原子的最外层电子数与次外层电子数之为3:4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4,M元素原子的最外层电子数与次外层电子数之为3:4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com