
【题目】已知下列反应:
①SO2+H2O=H2SO3 ②C+H2O=H2+CO
③2Al+6H+=2Al3++3H2↑ ④2Mg+CO2![]() 2MgO+C
2MgO+C
⑤2Na2O2+2H2O=4NaOH+O2↑ ⑥Ca2C2+2H20=Ca(OH)2+C2H2↑
(1)上述反应中不属于氧化还原反应的有_________(填各反应的序号,下同);反应物中H2O被还原的是_______;还原产物为单质的是_______。
(2)上述各反应所涉及到的物质中,属于弱电解质的是______(填化学式)。
(3)用单线桥表示反应④中电子转移的方向和数目___________________。
(4)高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠,溶液紫红色逐渐褪去,出现红褐色沉淀,溶液的pH逐渐增大。请写出该反应的离子方程式__________________。
(5)下列两组混合物,括号内为杂质,填写除去杂质所需电解质溶液(限定只能用含有钠元素的试剂,假设用量可控),并写出反应的离子方程式。
①Fe2O3(SiO2) 试剂________,________________________________________。
②Na2CO3(NaAlO2) 试剂________,________________________________________。
【答案】 ①⑥ ② ②③④ H2O,H2SO3 ![]() 2FeO42-+3NO2-+5H2O=2Fe(OH)3↓+3NO3-+4OH- NaOH SiO2+2OH-=SiO32-+H2O NaHCO3, 【答题空10】HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓
2FeO42-+3NO2-+5H2O=2Fe(OH)3↓+3NO3-+4OH- NaOH SiO2+2OH-=SiO32-+H2O NaHCO3, 【答题空10】HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓
【解析】(1)反应前后有元素化合价升降的反应是氧化还原反应,则上述反应中不属于氧化还原反应的有①⑥;②中氢元素化合价降低,H2O被还原;②③中氢气均是还原产物,④碳元素化合价降低,单质碳为还原产物。(2)弱酸弱碱、水以及少部分盐是弱电解质,属于弱电解质的是H2O,H2SO3;(3)反应中镁元素化合价从0价升高到+2价,碳元素从+4价降低到+2价,因此用单线桥表示反应④中电子转移的方向和数目为![]() ;(4)高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠,溶液紫红色逐渐褪去,出现红褐色沉淀,溶液的pH逐渐增大,这说明反应中产生氢氧化铁沉淀和氢氧根,说明亚硝酸钠是还原剂,被氧化为硝酸根,则该反应的离子方程式为2FeO42-+3NO2-+5H2O=2Fe(OH)3↓+3NO3-+4OH-。(5)①二氧化硅是酸性氧化物,可以用氢氧化钠溶液除去氧化铁中的二氧化硅,离子方程式为SiO2+2OH-=SiO32-+H2O;②偏铝酸钠能与碳酸氢钠反应生成碳酸钠,可用来除去碳酸钠中的偏铝酸钠,反应的离子方程式为HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓。
;(4)高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠,溶液紫红色逐渐褪去,出现红褐色沉淀,溶液的pH逐渐增大,这说明反应中产生氢氧化铁沉淀和氢氧根,说明亚硝酸钠是还原剂,被氧化为硝酸根,则该反应的离子方程式为2FeO42-+3NO2-+5H2O=2Fe(OH)3↓+3NO3-+4OH-。(5)①二氧化硅是酸性氧化物,可以用氢氧化钠溶液除去氧化铁中的二氧化硅,离子方程式为SiO2+2OH-=SiO32-+H2O;②偏铝酸钠能与碳酸氢钠反应生成碳酸钠,可用来除去碳酸钠中的偏铝酸钠,反应的离子方程式为HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】一定条件下反应A(g)+B(g)C(g)△H<0达到平衡后,据下列图象判断:
达到新的平衡对应的图象 | 平衡移动方向 | |
(i)使用催化剂 | ||
(ii)升温 | ||
(iii)降压 | ||
(iv)增加A的量 | ||
(v)减少C的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列分析错误的是

A. 过氧化钠与水反应产生的气体为O2
B. 过氧化钠与水反应需要MnO2作催化剂
C. 实验②、③证明使酚酞褪色的不是氢氧化钠和氧气
D. 过氧化钠与水反应可能生成了具有漂白性的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的金属阳离子为Mg2+、Al3+,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的物质的量与加入NaOH的物质的量的关系如图所示。

(1)由此确定原溶液中一定还大量含有某阳离子,它可能是________。
(2)若溶质为MgCl2和Al2(SO4)3,则原溶液中铝离子的物质的量为______________。
(3)下列图象中,横坐标表示加入试剂或通入气体的物质的量,纵坐标表示产生沉淀的质量,用图象的序号或文字回答下列问题:

Ⅰ.表示向AlCl3溶液中逐渐滴加NaOH溶液的是______;
Ⅱ.表示向NaAlO2溶液中逐渐滴加稀盐酸的是________;
Ⅲ.表示向NaAlO2溶液中通入CO2的是________;
Ⅳ.③图____________(填“能”或“不能”)代表向含NaOH的澄清石灰水中通入CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A.降低温度
B.加入适量的水
C.加入少量CuSO4溶液
D.加入浓度较大的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用软锰矿(主要含MnO2,还含有少了SiO2、Al2O3 、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
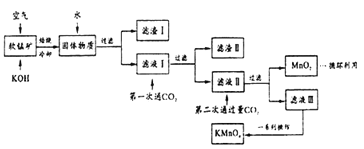
(1)配平焙烧时MnO2参与的化学反应:□MnO2+□_____+□O2 ![]() □K2MnO4+□H2O;第二次通入过量CO2时发生反应的离子方程式为:______________________。
□K2MnO4+□H2O;第二次通入过量CO2时发生反应的离子方程式为:______________________。
(2)滤渣I、II的成分中能与NaOH 反应的是__________________ (填化学式)。产生滤渣II时不能用稀盐酸代替CO2,因为______________________。
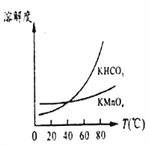
(3)将滤液Ⅲ进行一系列操作可得到KMnO4晶体。由下图可知,从滤液Ⅲ得到KMnO4需经过____、____洗涤等操作。
(4)用重结晶提纯的产品配制成0.10mol·L-1 的酸性KMnO4溶液来测定某草酸样品的纯度(杂质不参与反应,草酸为弱酸,分子式H2C2O4)。
①试给出反应的离子方程式:_______________________。
②若某测定大致共需要230毫升酸性KMnO4溶液,配制时所需玻璃仪器为:___、___烧杯、胶头滴管等。
③取草酸样品5 克,配成100mL溶液,取20mL于适当容器中,用前述所配酸性KMnO4溶液滴定,至反应结束消耗KMnO4溶液20mL,则样品的纯度为: ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求写出下列的方程式。
(1)过氧化钠与水反应的化学方程式:________;
(2)硫酸铝溶液与氨水反应的离子方程式:________;
(3)铁单质与水蒸气反应的化学方程式:________;
(4)二氧化硅与氢氟酸反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是配制一定物质的量浓度溶液的过程示意图。下列说法错误的是

A. 所配制的Na2CO3,溶液的物质的量浓度为1.0mol/L
B. 操作2是将溶解的Na2CO3,溶液转移到容量瓶中
C. 操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐
D. 操作4如果仰视,结果配得溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是立方烷的球棍模型,下列有关说法不正确的是( ) 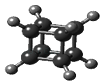
A.它的一氯代物只有一种同分异构体
B.它的二氯代物有两种同分异构体
C.它的分子式为C8H8
D.它与苯乙烯(C6H5﹣CH=CH2)互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com