
【题目】下列说法不正确的是
A. 稀醋酸中加入少量醋酸钠固体能降低醋酸的电离程度
B. 25 ℃时,硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C. CaCO3的水溶液导电性很弱,但CaCO3是强电解质
D. 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍
【答案】D
【解析】
A、醋酸溶液中存在 CH3COOH ![]() CH3COO-+H+,加入醋酸钠固体,增加CH3COO-的浓度,抑制CH3COOH的电离,故A说法正确;B、H2S属于弱酸,Na2S属于强电解质,等浓度时Na2S溶液中离子浓度大于H2S溶液中离子浓度,因此等浓度时Na2S溶液的导电能力强于H2S溶液,故C说法正确;D、CaCO3属于难溶电解质,其水溶液的导电能力很弱,但CaCO3属于盐,属于强电解质,故C说法正确;D、盐酸属于强酸,醋酸属于弱酸,醋酸溶液中存在CH3COOH
CH3COO-+H+,加入醋酸钠固体,增加CH3COO-的浓度,抑制CH3COOH的电离,故A说法正确;B、H2S属于弱酸,Na2S属于强电解质,等浓度时Na2S溶液中离子浓度大于H2S溶液中离子浓度,因此等浓度时Na2S溶液的导电能力强于H2S溶液,故C说法正确;D、CaCO3属于难溶电解质,其水溶液的导电能力很弱,但CaCO3属于盐,属于强电解质,故C说法正确;D、盐酸属于强酸,醋酸属于弱酸,醋酸溶液中存在CH3COOH ![]() CH3COO-+H+,盐酸的浓度时醋酸浓度的二倍,则盐酸中H+浓度大于醋酸中的二倍,故D说法错误。
CH3COO-+H+,盐酸的浓度时醋酸浓度的二倍,则盐酸中H+浓度大于醋酸中的二倍,故D说法错误。


科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的是( )
C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的是( )
A.v(A)=0.2mol/(Ls)B.v(B)=0.6mol/(Ls)
C.v(C)=0.3mol/(Ls)D.v(D)=0.5mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol.L-1,向该溶液中逐滴加入0.010mol.L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,最快的是
A. v(A2)=0.008 mol·L-1·s-1B. v(A2)=0.3 mol·L-1·min-1
C. v(AB3)=0.01 mol·L-1·s-1D. v(B2)=0.012 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)写出CO2和Na2O2反应的化学方程式:___________________________________。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?__________,简要说明理由:_______________________________________________。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
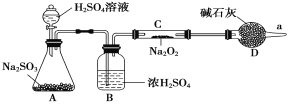
装置中B的作用是_________________,D的作用是_____________________。
(4)将足量的Na2O2投入到含有下列离子的溶液中:NO3-、S2-、HCO3-、CO32-、Na+,设反应完毕后,无固体析出,则上述离子数目减少的有__________,数目增多的离子有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径:X>Y>Z>W
B. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
C. 气态氢化物的稳定性:Z>W>Y
D. Y元素存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:
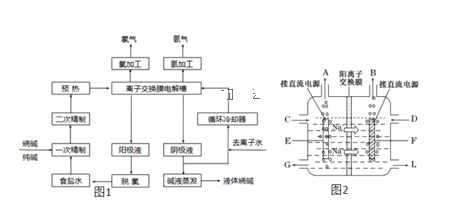
(1)该流程中可以循环的物质是____。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式___。
(3)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是___,E电极的名称是___。电解总反应的离子方程式为____。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为___。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器中,可逆反应A(s) ![]() B+C(g) △H=-Q kJ·mol-1 达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) △H=-Q kJ·mol-1 达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A. 产物B的状态只能为固态或液态
B. 平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C. 保持体积不变,向平衡体系中加入B,平衡一定向逆反应方向移动
D. 若开始时向容器中加入1 mol B和1 mol C,达到平衡时吸收热量QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(Al3+)
B.x=20时,溶液中所发生反应的离子方程式为Al3++2SO42-+2Ba2++4OH-=AlO2-+2H2O+2BaSO4↓
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.滴加过程中,生成沉淀的最大物质的量为0.003 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com