
分析 混合物加热时,发生反应:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,向反应后的固体混合物中加入稀硫酸,发生反应:FeS+H2SO4=FeSO4+H2S↑,若混合物中Fe有剩余,则还发生反应:Fe+H2SO4=FeSO4+H2↑,由方程式可知得到气体物质的量等于Fe的物质的量,生成的气体燃烧时,发生反应:2H2S+3O2=2H2O+2SO2,2H2+O2=2H2O,由方程式可知,气体只有H2S时,消耗氧气最多,气体只有H2时,消耗氧气达极小值.
解答 解:混合物加热时,发生反应:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,向反应后的固体混合物中加入稀硫酸,发生反应:FeS+H2SO4=FeSO4+H2S↑,若混合物中Fe有剩余,则还发生反应:Fe+H2SO4=FeSO4+H2↑,由方程式可知得到气体物质的量等于Fe的物质的量,即生成气体$\frac{ag}{56g/mol}$=$\frac{a}{56}$mol,标况下气体体积为$\frac{a}{56}$mol×22.4L/mol=0.4aL.
生成的气体燃烧时,发生反应:2H2S+3O2=2H2O+2SO2,2H2+O2=2H2O,由方程式可知,气体只有H2S时,消耗氧气最多,消耗氧气体积最大为0.4a L×$\frac{3}{2}$=0.6a L,则消耗空气体积最大为0.6a L÷0.2=3a L;
气体只有H2时,消耗氧气达极小值,可知氧气极小值为0.4a L×$\frac{1}{2}$=0.2a L,则消耗空气体积极小值为0.2a L÷0.2=a L,
故V的取值范围为:a<V≤3a,
答:V的取值范围为a<V≤3a.
点评 本题考查混合物有关计算,关键是明确发生的反应,再利用极端法进行分析解答,使问题化难为易,化繁为简,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应放出的热量为0.2akJ | |
| B. | 平衡时H2O的转化率为60% | |
| C. | 升高温度,v(正)加快v(逆)减慢,平衡正向移动 | |
| D. | 将容器的体积压缩为1L,H2的体积分数变为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
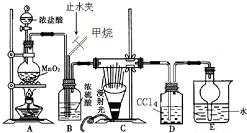 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如图:
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如图: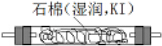 B.
B.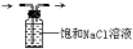 C.
C.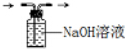
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同 | |
| B. | 无法比较 | |
| C. | 依次为0.12mol/L、0.24mol/L、0.36mol/L | |
| D. | 依次为0.06mol/L、0.12mol/L、0.18mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向正反应方向移动,c(H+)增大 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动,c(H+)减少 | |
| C. | 加入少量0.1mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动,c(CH3COO-)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com