
 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:分析 原子序数依次增大的五种元素A、B、C、D、E,其中A的一种核素中没有中子,则A为H元素;B原子基态时最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;D原子基态时2p原子轨道上有2个未成对的电子,原子序数大于碳,故D核外电子排布为1s22s22p4,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍,则E的价电子排布为3d64s2,为Fe元素,据此解答.
解答 解:原子序数依次增大的五种元素A、B、C、D、E,其中A的一种核素中没有中子,则A为H元素;B原子基态时最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;D原子基态时2p原子轨道上有2个未成对的电子,原子序数大于碳,故D核外电子排布为1s22s22p4,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍,则E的价电子排布为3d64s2,为Fe元素,
(1)C2H4分子结构简式为H2C=CH2,C原子形成3个σ键,没有孤对电子,故碳原子轨道的杂化类型为sp2杂化,1mol C2H4含有σ键的数目为5mkol,π键为1mol,分子中σ键和π键个数比为5:1,
故答案为:sp2;5:1;
(2)同周期随原子序数增大,元素电负性呈增大趋势,所以,C、H、O、N、的电负性大小为O>N>C>H,因为氨分子之间有氢键,所以化合物NH3的沸点比化合物CH4的高,
故答案为:O>N>C>H;氨分子之间有氢键;
(3)元素C、O形成的一种化合物与元素N、O形成的一种化合物互为等电子体,应是CO2与N2O,
故答案为:N2O;
(4)元素E为Fe元素能形成多种配合物,如:Fe(CO)5等.
①基态Fe原子的价电子排布图为[Ar]3d64s2,
故答案为:[Ar]3d64s2;
②Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,所以Fe(CO)5晶体属于分子晶体,根据化合价代数和为0可知,该化合物中铁为0价,
故答案为:分子晶体;0;
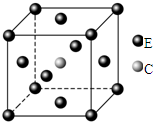
(5)铁和氮形成的晶体的晶胞结构如图所示,晶胞中铁原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氮原子数目为1,原子数目之比为4:1,故该氯化物的化学式是Fe4N,晶胞质量为 $\frac{238}{N{\;}_{A}}$g×,若两个最近的Fe原子间的距离为acm,则该晶体的晶胞边长为$\sqrt{2}$acm,则该晶体密度为 $\frac{\frac{238}{{N}_{A}}}{(\sqrt{2}{a)}^{3}}$g/cm3=$\frac{119\sqrt{2}}{2{a}^{3}{N}_{A}}$g/cm3,
故答案为:Fe4N; $\frac{119\sqrt{2}}{2{a}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、杂化轨道、化学键、等电子体、配合物、晶胞计算等,推断元素是解题关键,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,用电子式表示FM2的形成过程
,用电子式表示FM2的形成过程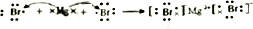 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
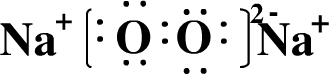 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含离子键的化合物才是离子晶体 | |
| B. | (NH4)2SO4晶体是含有离子建、共价键和配位键的分子晶体 | |
| C. | 由于I-I中的共价键键比F-F、Cl-Cl、Br-Br都弱,因此在卤素单质中I2的熔点、沸点最低 | |
| D. | 分子晶体中一定不存在离子键,而离子晶体中可能存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO | B. | CH3COOCH2CH3 | C. | HOOCCOOH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,H2SO4浓度增加 | |
| B. | 放电时,负极的电极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | 在充电时,电池中每转移1 mol电子,理论上生成2 mol硫酸 | |
| D. | 在充电时,阴极发生的反应是PbSO4-2e-+2H2O═PbO2+SO42-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com