
【题目】同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4 >H2YO4>H3ZO4,则下列各判断中正确的是( )
A. 非金属性:X>Y>Z B. 原子半径:X>Y>Z
C. 气态氢化物稳定性:X<Y<Z D. 原子序数:X<Y<Z
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
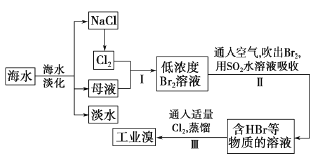
(1)请列举海水淡化的两种方法:________、_________。
(2)步骤I中己获得Br2,步骤II中又将Br2还原为Br-。其目的是_____。
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95% 。有关反应的离子方程式为_________。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法。查阅了有关资料知:Br2的沸点为59 ℃.微溶于水,有毒并有强腐蚀性。他们参观生产过程后.画了如下装置简图:
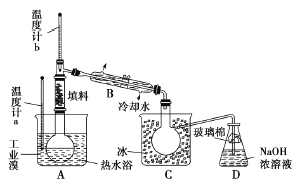
请你参与分析讨论:
①图中仪器B的名称是_______。
② 整套实验装皿中仪器连接均不能用橡胶塞和橡胶管。其原因是_______。
③ 实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?_______。
④ C中液体颜色为_______。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr,溶液,充分反应后.再进行的分离操作是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
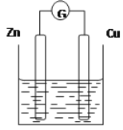
Date:2016.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Cu极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol ⑥正极的电极反应式:Zn―2e―=Zn2+ |
(1)在卡片上,叙述合理的是 (填序号)。
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是 。
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是 。
(4)如果把硫酸换成硫酸铜溶液,猜测 (填“锌极”或“铜极”)变粗,原因是 (用电极方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体,下列说法中错误的是
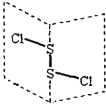
A.S2Cl2的结构式为 Cl—S—S—Cl
B. S2Cl2与水反应时只有S—Cl断裂
C.S2Br2含有极性键和非极性键
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学反应原理相关的叙述不正确的是( )
A.放热反应中生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.盖斯定律实质上是能量守恒定律的体现
D.电离平衡、水解平衡和沉淀溶解平衡均为动态平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com