
| A. | pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍 | |
| B. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
分析 A.pH相差2,氯离子浓度相差100倍,PH=4.0的番茄汁中c(H+)是PH=6.0的牛奶中c(H+)的100倍;
B、溶液导电能力的强弱决定于离子浓度的大小,与电解质强弱无关;
C、根据AgCl的沉淀溶解平衡分析;
D、pH=5.6的CH3COOH与CH3COONa混合溶液显酸性,据电荷守恒分析.
解答 解:A.pH=4.0,c(H+)=10-4.0 mol•L-1,pH=6.0,其c(H+)=10-6.0 mol•L-1,c(H+)是100倍的关系,故A正确;
B、浓度较大的弱电解质的导电能力可能比浓度很小的强电解质溶液导电能力强,故B错误;
C、AgCl在水中存在沉淀溶解平衡,AgCl(s)?Ag+(aq)+Cl-(aq),加入Cl-平衡逆移,Cl-浓度越大,则AgCl的溶解度越小,所以AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不同,前者小,故C错误;
D、pH=5.6的CH3COOH与CH3COONa混合溶液显酸性,据电荷守恒可知c(Na+)<c(CH3COO-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较、盐的水解、沉淀溶解平衡的移动等内容,侧重于对有关原理应用的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
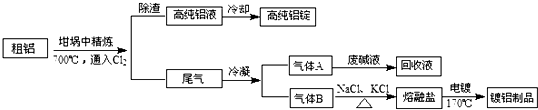
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2NH3+3CuO→3Cu+N2+3H2O | B. | 2Na+2NH3→2NaNH2+H2↑ | ||
| C. | 4NH3+6NO→5N2+6H2O | D. | 3SiH4+4NH3→Si3N4+12H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活动性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 铵盐受热易分解,实验室常加热硝酸铵与氢氧化钙的混合物制取氨气 | |
| C. | 氯化铁有氧化性,工业上用FeCl3溶液蚀刻铜箔制造电路板 | |
| D. | 氨水具有弱碱性,可与饱和氯化铁溶液反应制得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水跟盐酸反应:H++OH-═H2O | |
| B. | 硫酸铜溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 将溴水加入碘化钾溶液中:Br2+2I-═2Br-+I2 | |
| D. | 盐酸滴在石灰石上:CaCO3+2 H+═Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com