
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
分析 (1)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律计算反应CO ( g )+2H2 ( g )?CH3OH ( l )的焓变,写出热化学方程式;
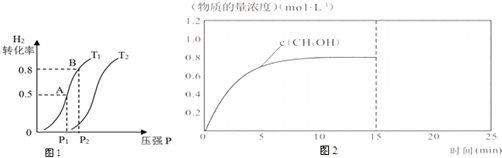
(2)①反应自发进行的判断依据是△H-T△S<0,据此分析判断,压强一定温度越高平衡逆向进行,氢气的转化率减小;
②在容积可变的密闭容器中充入1mol CO ( g ) 和2molH2 ( g )生成CH3OH( g ),A点氢气转化率0.5,
CO ( g )+2H2 ( g )?CH3OH (g )
起始量(mol) 1 2 0
变化量(mol) 0.5 1 0.5
平衡量(mol) 0.5 1 0.5
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
B点和A点温度不变平衡常数不变,结合三行计算列式计算平衡浓度,结合平衡常数计算气体体积;
③增加甲醇产率需要平衡正向进行,注意容器为恒温恒压容器;
(3)在容积固定为2L的密闭容器中充入2molCO( g )和6molH2( g )生成CH3OH( g ),图中中是甲醇的浓度增加,达到平衡状态甲醇浓度为0.8mol/L,据此计算甲醇反应速率,速率之比等于化学方程式计量数之比得到氢气的反应速率,计算平衡状态下CO的浓度,若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,改变条件后依据氢气的转化率列三行计算,得到平衡状态下一氧化碳的浓度,据此画出图象变化.
解答 解:(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
由盖斯定律可知用①+③-$\frac{2}{3}$×②得反应CO(g)+2H2(g)=CH3OH(l),
该反应的反应热△H=-283.0kJ•mol-1+(-285.8kJ•mol-1)-$\frac{2}{3}$(-726.5kJ•mol-1)=-128.1kJ•mol-1,
即CO(g)+2H2(g)=CH3OH(l)△H=-128.1kJ•mol-1.
故答案为:-128.1;
(2)①CO ( g )+2H2 ( g )?CH3OH ( l ),反应为放热反应,△H<0,气体体积减小反应的熵变△S<0,图象中压强一定随温度升高,平衡逆向进行,氢气转化率减小,则T1<T2,
故答案为:<;<;
②在容积可变的密闭容器中充入1mol CO ( g ) 和2molH2 ( g )生成CH3OH( g ),A点氢气转化率0.5,
CO ( g )+2H2 ( g )?CH3OH (g )
起始量(mol) 1 1 0
变化量(mol) 0.5 1 0.5
平衡量(mol) 0.5 1 0.5
平衡常数K=$\frac{\frac{0.5}{2}}{\frac{0.5}{2}×(\frac{1}{2})^{2}}$=4,
若达到平衡状态B 时转化率为0.8,结合平衡三行计算列式计算,
CO ( g )+2H2 ( g )?CH3OH (g )
起始量(mol) 1 2 0
变化量(mol) 0.8 1.6 0.8
平衡量(mol) 0.2 0.4 0.8
B点温度不变平衡常数不变,K=$\frac{\frac{0.8}{V(B)}}{\frac{0.2}{V(B)}×(\frac{0.4}{V(B)})^{2}}$=4
则容器的体积V(B)=0.4
故答案为:4,0.4;
③A.反应为放热反应,升高温度平衡逆向进行,甲醇产率减小,故A错误;
B.从平衡体系中及时分离CH3OH,平衡正向进行,甲醇产率增大,故B正确;
C.充入He总压增大分压不变,平衡不变,甲醇产率不变,故C错误;
D.体积可变的容器中再充入0.5mol CO和1mol H2 ,相当于压强增大,体积增大,最后得到相同的平衡状态,转化率不变,甲醇产率不变,故D错误;
故答案为:B;
(3)V(CH3OH)=$\frac{△c}{△t}$=$\frac{0.8mol/L}{10min}$=0.08mol/(L•min),
根据方程式得V(CH3OH):V(H2)=1:2,
所以V(H2)=2×0.08mol/(L•min)=0.16mol/(L•min);
2H2(g)+CO(g)=CH3OH(g)
起始量(mol/L) 3 1 0
变化量(mol/L) 1.6 0.8 0.8
平衡量(mol/L) 1.4 0.2 0.8
此时CO的平衡浓度为 0.2mol/L,
改变温度,假设在20分钟时达到新平衡,氢气的转化率为33.3%,则氢气转化的浓度为△C=$\frac{6mol}{2L}$×33.3%=1mol/L,
2H2(g)+CO(g)=CH3OH(g)
起始浓度(1mol/L) 3 1 0
转化浓度(1mol/L) 1 0.5 0.5
平衡浓度(1mol/L) 2 0.5 0.5
CO平衡浓度为0.5mol/L,15min时CO浓度为0.2mol/L.升温平衡逆向进行,一氧化碳物质的量浓度增大,据此画出变化曲线为: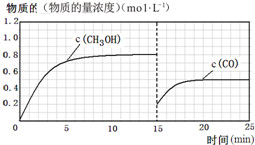 ,
,
故答案为:0.16mol•L-1•min-1;
点评 本题考考查了热化学方程式和盖斯定律计算应用,平衡常数的计算及应用,影响平衡的因素分析判断,题目涉及的知识点较多,综合性较强,题目难度中等.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| 温度/°C | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | △H>0 | |
| B. | 1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2的物质的量分别为0.5mol、1.8mol,此时反应向正反应方向进行 | |
| C. | 其他条件不变,向平衡体系充入CO2气体,K值减小 | |
| D. | 其他条件不变,升高温度,可以提高CO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
用H2O2溶液处理含NaCN的废水的反应原理为:NaCN + H2O2 + H2O = NaHCO3 + NH3,已知:HCN的酸性比H2CO3弱。下列有关说法正确的是( )
A.该反应中氮元素被氧化
B.该反应中H2O2作还原剂
C.0.1 mol·L-1 NaCN溶液中含有HCN和CN-的总数为0.1×6.02×1023
D.实验室配制NaCN溶液时,需加入适量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:实验题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
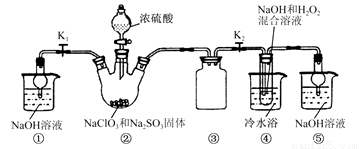
(1) 装置②中产生ClO2气体的化学方程式为 ;
装置④中制备NaClO2的化学方程式为 。
(2) 装置③的作用是 。
(3) 从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60 ℃干燥,得到成品。
实验II. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2?+4I?+4H+==2H2O+2I2+Cl?);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L?1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32?=2I?+S4O62?)。
(4) 达到滴定终点时的现象为 。
(5) 该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6) 在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
某羧酸酯的分子式为C57H104O6,1 mol该酯完全水解可得到3 mol羧酸M和1 mol甘油[HOCH2CH(OH)CH2OH]。羧酸M的分子式为( )
A.C17H32O2 B.C18H34O2 C.C18H36O2 D.C19H36O2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ | |
| C. | 氢氧化铝中和胃酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | Ca(HCO3)2溶液中加入过量KOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评 价 |
| A | 向沸腾的蒸馏水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O=Fe(OH)3↓+3H+ | 正 确 |
| B | 大理石溶于醋酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
| C | 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | 错误,产物不符合客观事实 |
| D | NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3- | 正 确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com