
| 电极反应式 | 出现环境 | |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═O2↑+2H2O | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | 2H2O+2e-═H2↑+2OH- | 用Cu作电极电解NaOH溶液的阴极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碱性条件下的氢氧燃料电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应;
B.弱酸性环境下,钢铁发生吸氧腐蚀,正极上氧气得电子发生发生还原反应;
C.用铜作电极电解氢氧化钠溶液,阴极上阳离子得电子发生还原反应;
D.用惰性电极电解H2SO4溶液时,阳极发生氧化反应生成氧气.
解答 解:A.碱性条件下的氢氧燃料电池中,负极上的电极反应式为:H2-2e-+2OH-=2H2O,故A错误;
B.弱酸性环境下钢铁的吸氧腐蚀,正极上氧气得电子生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,故B错误;
C.用铜做电极电解NaOH溶液时,阴极上的电极反应式为:2H2O+2e-═H2↑+2OH-,故C正确;
D.用惰性电极电解H2SO4溶液时,阳极发生氧化反应生成氧气,电极方程式为:4OH--4e-═O2↑+2H2O,故D错误;
故选C.
点评 本题考查原电池和电解池原理,明确阴阳极和正负极上的反应类型是解本题的关键,注意C选项中,铜作电解池阳极时,阳极上铜失电子而不是溶液中阴离子失电子,为易错点.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用盐酸除铁锈 | |
| B. | 用纯碱溶液清洗油污 | |
| C. | 加热蒸干AlCl3溶液得到Al(OH)3固体 | |
| D. | 实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
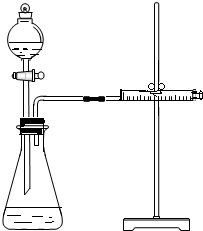 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②分别投入大小、形状相同的Cu、Fe、Mg | 反应速率Mg>Fe,Cu反应最慢 | 金属性质越活泼,反应 速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
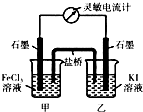
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式为: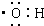 | |
| B. | 甘氨酸的结构简式为:C2H5NO2 | |
| C. | 间羟基苯甲酸的结构简式为: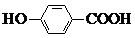 | |
| D. | Na2S在溶液中水解的离子方程式为:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
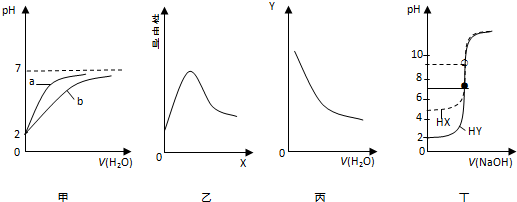
| A. | 图甲表示pH均为2的盐酸和醋酸分别用水稀释时pH变化曲线,其中a为醋酸 | |
| B. | 图乙表示0.1 mol•L-1 醋酸中加入X后溶液导电性曲线,则X可能是0.1 mol•L-1 氨水 | |
| C. | 图丙表示0.1 mol•L-1 氨水不断用水稀释曲线,Y可能是c(OH-) | |
| D. | 图丁表示0.0100 mol•L-1 NaOH溶液分别滴定20.00 mL 浓度均为0.0100 mol•L-1HX和HY的滴定曲线,可判断HX酸性比HY强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有七个主族,八个副族 | |
| B. | 每个短周期都有8种元素,每个长周期中都有18种元素 | |
| C. | 第三主族位于元素周期表的第三列(从左往右) | |
| D. | 零族位于元素周期表的第18列(从左往右) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com