
 (3)白磷 (4)氯气 (5)
(3)白磷 (4)氯气 (5)

分析 (1)根据热化学方程式的书写原则写出热化学方程式,方程中的热量和化学计量数要对应;
(2)结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物;
具有相同分子式而结构不同的化合物互为同分异构体;
相同元素组成,不同形态的单质互为同素异形体;
有相同质子数,不同中子数的原子互为同位素.
解答 解:(1)①12g焦炭不完全燃烧,生成CO并放出a kJ热量,则1mol焦炭不完全燃烧,放出热量为$\frac{a}{12}×12$=aKJ,该反应的热化学方程式为C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-a kJ/mol,
故答案为:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-a kJ/mol;
②标准状况下22.4L甲烷完全燃烧,放出b kJ热量,则1mol甲烷完全燃烧,放出热量为$\frac{b}{22.4}×22.4$=bKJ,该反应的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-bkJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-bkJ/mol;
(2) 、
、 、
、 结构相似,分子组成相差1个“CH2”原子团,故互为同系物;
结构相似,分子组成相差1个“CH2”原子团,故互为同系物;
(5) 和(8)
和(8) 分子式相同,但结构不同,故互为同分异构体;
分子式相同,但结构不同,故互为同分异构体;
(1)红磷和(3)白磷都是由磷元素形成的不同单质,故互为同素异形体;
(6)${\;}_{17}^{37}$Cl 和(7)${\;}_{17}^{35}$Cl质子数相同,中子数不同,故互为同位素,
故答案为:(2),(5)和(8);(5)和(8);(1)和(3);(6)和(7).
点评 本题考查同位素、同素异形体、同分异构体、同系物的概念,以及热化学方程式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. |  实验:振荡后静置,上层溶液颜色保持不变 | |
| B. |  实验:试管溶液中出现气泡,溶液先出现浑浊后变澄清 | |
| C. |  实验:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 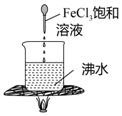 实验:加热至混合液呈红褐色,停止加热,该分散系能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;A 分子中能够共平面的原子 最多为8个,写出A与溴的四氯化碳反应的化学方程式
;A 分子中能够共平面的原子 最多为8个,写出A与溴的四氯化碳反应的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 石墨电极上发生氧化反应 | |
| B. | 当有6.02×1023个电子转移时,Fe电极减少28 g | |
| C. | 该电池负极的反应式为2Fe2+-2e-═2Fe3+ | |
| D. | 盐桥中Cl-移向FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成lmolH-Cl键放出的能量 | B. | 石墨转变成金刚石吸收的能量 | ||
| C. | 1molO2形成2mo1O原子吸收的能量 | D. | 水蒸气变成液态水放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 迄今人类发现的元素中,金属元素和非金属元素种数相近 | |
| B. | 元素周期表有18个纵行16个族,分为主族、副族、第Ⅷ族和零族 | |
| C. | 元素周期表有七个周期,分为短周期和长周期 | |
| D. | 人们在周期表中金属与非金属的分界处可以找到半导体材料,如硅、锗等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com