
在密闭容器中发生如下反应mA(g)+nB(g)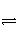
 pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的 ,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
A.m+n>pB.平衡向逆反应方向移动
C.A的转化率提高D.C的体积分数增加
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示.下列判断正确的是( )

|
| A. | 原子半径:丙<丁<戊 | B. | 氢氧化物碱性:丙>丁>戊 |
|
| C. | 金属性:甲>丙 | D. | 最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
火箭发射的燃料有很多,偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生巨大能量,可作为航天运载火箭的推动力.下列叙述中正确的是( )
A. 6.02×1023个偏二甲肼分子的质量为60g
B. 偏二甲肼的摩尔质量为60g
C. 1mol偏二甲肼的质量为60g/mol
D. 6g偏二甲肼含有NA个偏二甲肼分子
查看答案和解析>>
科目:高中化学 来源: 题型:
现有含CaO杂质的CaC2试样.设计以下实验,测定CaC2试样的纯度.(反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑),请从下图中选用适当的装置,完成该实验.
(1)制取C2H2最好选④中的丙,所选用装置的连接顺序是(填各接口A~E的顺序): .
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为 .(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2(g)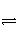
 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学平衡常数K的描述中,正确的是( )
A.K越大,正反应进行的程度越大
B.温度升高,K值增大
C.反应物的转化率增大时,K值一定增大
D.平衡向逆反应方向移动时,K值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)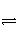
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1) 写出该反应的平衡常数表达式:K=_____________________________________。
已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2s内该反应的平均速率v=_____________________________________
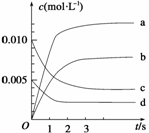
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体b.适当升高温度c.增大O2的浓度d.选择高效催化剂
附加题:
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列三个反应的化学方程式:I2+SO2+2H2O═H2SO4+2HI;2FeCl2+Cl2═2FeCl3,2FeCl3+2HI═2FeCl2+2HCl+I2有关物质的还原性依次增强的顺序是( )
‚
|
| A. | I﹣>Fe2+>Cl﹣>SO2 | B. | Cl﹣>Fe2+>SO2>I﹣ |
|
| C. | Fe2+>I﹣>Cl﹣>SO2 | D. | SO2>I﹣>Fe2+>Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组顺序的排列不正确的是( )
A. 碱性强弱:NaOH>Mg(OH)2>Al(OH)3
B. 热稳定性:HF>HCl>H2S>PH3
C. 微粒半径:Na+>Mg2+>Al3+>F﹣
D. 熔点:SiO2>NaCl>I2>CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com