
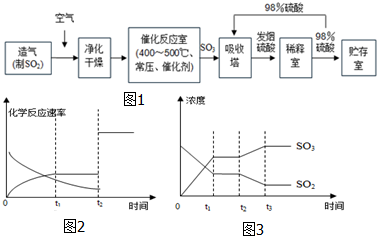
分析 (1)黄铁矿粉碎会增大反应物的接触面积加快反应速度;
(2)提高SO2平衡转化率,促进化学平衡向右移动,根据化学平衡移动影响因素判断;
(3)根据化学平衡状态特征判断分析,达到平衡时,一是等,二是定:
等是指v正=v逆,同一种物质:该物质的生成速率等于它的消耗速率;不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率;
定是指各成分含量保持不变:
①各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变;
②各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变;
③若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变;
④反应物的转化率、产物的产率保持不变;
(4)根据外界条件对化学平衡的影响判断,图2中t2正逆反应速率同时同等程度增大,对于2SO2+O2?2SO3,使用催化剂才能实现正逆反应速率同时同等程度增大;图3中时刻t2 SO3浓度增大,SO2浓度减小,即化学平衡向右移动,从温度、压强对平衡的影响进行分析.
解答 解:(1)反应物接触面积越大,反应越剧烈,黄铁矿粉碎会增大反应物的接触面积,加快反应速度,故答案为:增大固体的接触面积,提高反应速率;
(2)提高SO2平衡转化率,促进化学平衡向右移动,
a.正反应方向气体体积减小,减小压强,化学平衡向逆反应方向移动,故a错误;
b.正反应方向放热,升高温度,化学平衡向逆反应方向移动,故b错误;
c.增大氧气浓度,化学平衡向右移动,故c正确;
d.减小生成物浓度,化学平衡向右移动,故d正确;
故答案为:cd;
(3)a、SO2和SO3浓度相等,并不能说明各物质浓度不变,不能判断是否平衡,故a错误;
b、SO2百分含量保持不变,即各物质浓度不再发生变化,达到化学平衡状态,故b正确;
c、反应前后气体物质的量不同,容器中气体的压强不变,则达到化学平衡状态,故c正确;
d、SO3的生成速率与SO2的消耗速率相等,均为正反应方向,不能判断正逆反应速率是否相等,不能判断是否平衡,故d错误;
故答案为:bc;
(4)图2中,t2正逆反应速率同时同等程度增大,由于反应前后气体物质的量不同,增大压强化学平衡发生移动,即正逆反应速率变化程度不同,所以外界条件只能为加入催化剂;图3中时刻t2 SO3浓度增大,SO2浓度减小,即化学平衡向右移动,又由于在t2时,二者浓度不变,即压强不变,或者说,不是因为压强变化而导致平衡的移动,只能为温度的影响,所以条件为降低温度,故答案为:加入催化剂;降低温度.
点评 本题是一道综合性的考题,涉及化学反应速率、化学平衡的移动以及v-t图的知识,难度较大,综合性强.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
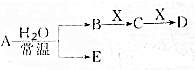 已知A、B、C、D、E、X的转化关系如图所示:
已知A、B、C、D、E、X的转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 压强Mpa 转化率% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中H+、NH4+、NO3-、Al3+可以大量共存 | |
| B. | 该溶液中通入足量CO2气体无明显现象 | |
| C. | 用该溶液浸泡锅炉中的水垢,可使硫酸钙转化为碳酸钙 | |
| D. | 与苯酚溶液反应的离子方程式为:2C6H5OH+CO32-→2C6H5O-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由铝土矿冶铝:铝土矿$→_{Na_{3}AlF_{6}}^{电解}$Al | |
| B. | 制硫酸:硫铁矿$→_{空气}^{高温}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| C. | 由NaCl制漂白粉:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| D. | 合成氨:NH4Cl和Ca(OH)2固体$\stackrel{△}{→}$NH3$\stackrel{碱石灰}{→}$纯净干燥的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 B位于周期表中第二周期ⅦA族.
B位于周期表中第二周期ⅦA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com