
���� ��1������ƽ�ⳣ������������Ũ��ϵ������֮�����Է�Ӧ��Ũ��ϵ��֮������ϻ�ѧ����ʽ��дƽ�ⳣ������ʽ�������¶ȶ�ƽ���Ӱ�������
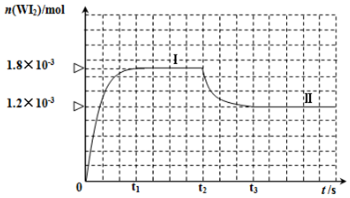
��2���ٸ����¶ȶԻ�ѧƽ���Ӱ�첢���ͼ�������
���ȸ���v=$\frac{��c}{��t}$���ͼ�����WI2�ķ�Ӧ���ʣ��ٸ��ݷ�Ӧ����֮�ȵ��ڼ�����֮�ȼ���v��I2����
�ۻ�ѧƽ�ⳣ������������Ũ��ϵ������֮�����Է�Ӧ��Ũ��ϵ��֮����
�ܷ�Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�ƽ��ʱ�������ʵ����ʵ�����Ũ�ȵȲ��ٷ����仯���ݴ˽����жϣ�
��3��������֪�Ȼ�ѧ����ʽ�����ø�˹���ɼ��㷴Ӧ�Ⱥ���д�Ȼ�ѧ����ʽ��
��� �⣺��1����֪����ʽI2��s��+2I-��aq��?I42-��aq��������ƽ�ⳣ������ʽΪ��K=$\frac{c��{{I}_{4}}^{2-}��}{{c}^{2}��{I}^{-}��}$����֪��Ӧ�ٵġ�H��0�����������¶�ƽ�����淽���ƶ�����ƽ�ⳣ����С��
�ʴ�Ϊ��$\frac{c��{{I}_{4}}^{2-}��}{{c}^{2}��{I}^{-}��}$����С��
��2���٣�1�������¶ȣ���ѧƽ�������ȷ����ƶ��������¶�ʱ��WI2�����ʵ������٣����Ը÷�Ӧ���淴Ӧ�����ƶ������淴Ӧ�����ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ����H��0���ʴ�Ϊ������
����Ϊv��WI2��=$\frac{\frac{1.8��1{0}^{-3}mol}{0.05L}}{3min}$=1.20��10-2��mol•L-1•min-1�����ڷ�Ӧ����֮�ȵ��ڼ�����֮�ȣ�����v��I2��=1.20��10-2mol•L-1•min-1��
�ʴ�Ϊ��1.20��10-2mol•L-1•min-1��
�۷�Ӧ��ʼʱ��������ʵ���Ϊn=$\frac{0.508g}{254g/mol}$=0.002mol����Ӧ��ƽ��ʱ����WI21.80��10-3mol�����ݻ�ѧ����ʽ��֪����Ҫ��1.80��10-3mol�μӷ�Ӧ��ʣ���0.0002mol������ƽ��ʱ��c��WI2��=$\frac{1.80��1{0}^{-3}mol}{0.05L}$=3.6��10-2mol/L��c��I2��=$\frac{0.0002mol}{0.05L}$=0.004mol/L����ΪW�ǹ��壬����K=$\frac{0.036mol/L}{0.004mol/L}$=9��
�ʴ�Ϊ��9��
�ܷ�Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�ƽ��ʱ�������ʵ����ʵ�����Ũ�ȵȲ��ٷ����仯��
A����Ӧ��ƽ��ʱ��I2��WI2��Ũ�ȿ������Ҳ���ܲ��ȣ��뷴Ӧ��ʼŨ�ȼ�ת�����йأ����Բ���֤���ﵽƽ��״̬����A����
B����λʱ���ڣ����������ĵ����ʵ����뵥�ʵ����ɵ����ʵ�����ȣ��÷�Ӧ�����淴Ӧ������ȣ����Դﵽƽ��״̬����B��ȷ��
C��ƽ��ʱ�������ʵ����ʵ�����������Ҳ���䣬������������䣬�����ܶȲ��ٱ仯����C��ȷ��
D���÷�Ӧ�Ƿ�Ӧǰ�������������ķ�Ӧ�����۷�Ӧ�Ƿ�ﵽƽ��״̬��ѹǿʼ�ղ��䣬��D����
�ʴ�Ϊ��B��C��
��3����֪�Ȼ�ѧ����ʽ��
��2 I2��s��+5O2��g��=2 I2O5��s������H=-75.56kJ•mol-1��
��2CO��g��+O2��g��=2 CO2��g������H=-566.0kJ•mol-1��
���ݸ�˹���ɽ�����ʽ�ڡ�$\frac{5}{2}$-�١�$\frac{1}{2}$��5CO��g��+I2O5��s��=5 CO2��g��+I2��s������H=��-566.0kJ•mol-1����-��-75.56kJ•mol-1����$\frac{1}{2}$=-1377.22kJ/mol��
�������Ȼ�ѧ��Ӧ����ʽΪ��5CO��g��+I2O5��s��=5 CO2��g��+I2��s����H=-1377.22kJ/mol��
�ʴ�Ϊ��5CO��g��+I2O5��s��=5 CO2��g��+I2��s����H=-1377.22kJ/mol��
���� �����Ե�Ԫ�ؼ��仯����Ϊ���壬������ƽ�ⳣ������Ӧ���ʵļ��㡢Ӱ�컯ѧƽ���ƶ������ء���˹���ɵ�֪ʶ�㣬�ۺ��Խ�ǿ����Ŀ�Ѷ��еȣ�����Ĺؼ��ǽ����е���Ϣ�����֪ʶ�л����������


 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ���� | ������ƽ�������룩 | С�ձ� | ����ǯ | ������ | ҩ�� | ��Ͳ |
| ���� |  |  |  |  |  |  |
| ��� | a | b | c | d | e |
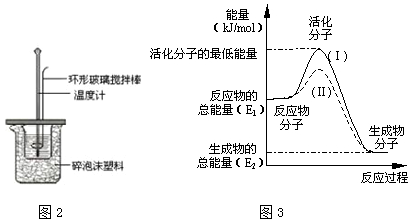
| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶� t2/��[ | �¶Ȳ�ƽ��ֵ ��t2-t1��/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Li������ý�������������Li2O2 | |
| B�� | 16O2��18O2��Ϊͬ���칹�� | |
| C�� | Ԫ�����ڱ���7�����壬7�����壬1��0�壬1�����壬��16���� | |
| D�� | HF��HCl��HBr��HI����������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ڢۢ� | C�� | �ڢݢ� | D�� | �ܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �-������ͭ��������Ļ���������Cu4O��PO4��2����ͨ�����з�Ӧ�Ʊ���
�-������ͭ��������Ļ���������Cu4O��PO4��2����ͨ�����з�Ӧ�Ʊ���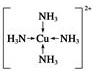 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com