
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示。下列叙述中,正确的是( )
2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示。下列叙述中,正确的是( )
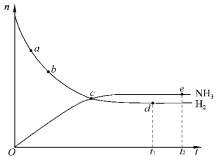
A. 点a的正反应速率比点b的小
B. 点c处正反应速率和逆反应速率相等
C. 点d (t1时刻) 和点 e (t2时刻) 处n(N2)相同
D. 在t2时刻,正反应速率大于逆反应速率
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】如图是某学校购买的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为1.84mol/L
B. 1mol Zn与足量的该硫酸反应产生2gH2
C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体。旧|法合成的反应是:
①(CH3)2C=O+HCN→(CH3)2C(OH)CN
②(CH3)2C(OH)CN+CH3OH+H2SO4→CH2=C(CH3)COOCH3+NH4HSO4
新法合成的反应是:③CH3C≡CH+CO+CH3OH![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
下列说法不正确的是
A. 反应②中CH3OH是CH2OHCH2OH(乙二醇)的同系物
B. 反应③符合绿色化学思想
C. 甲基丙烯酸甲酯有两种官能团
D. 反应①是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下:

资料显示:Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.5SO32-+2IO3-+2H+=I2+5SO42-+H2O;
Ⅳ.I2在碱性溶液中反应生成I-和IO3-。
(1)反应①的离子方程式_____________。
(2)方案甲中,根据I2的特性,分离操作X的名称是________________。
(3)已知:反应②中每吸收3molI2转移5mol电子,其离子方程式是_______________。
(4)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是_______________。
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、IO3-。请分别检验滤液中的I-、IO3-,将实验方案补充完整。实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、Na2SO3溶液
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B._______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是氯化钠晶体和二氧化碳晶体的结构示意图关于两种晶体说法正确的是 ( )
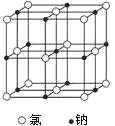
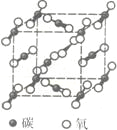
A. 两种晶体均以分子间作用力按一定规则排列组成
B. 构成两种晶体的微粒均是原子
C. 两者的硬度、熔沸点等物理性质与微粒间的作用力都有密切关系
D. 两种晶体均属于离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CH4中存在配位键的是
A. ①② B. ①③ C. ④⑤ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活紧切相关。下列说法正确的是
A.高纯度的硅单质用于制作光导纤维
B.合金相对于金属单质,其硬度更大、熔沸点更高
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.过氧化钠可以用在潜艇和呼吸面罩中作供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。下列叙述中不正确的是:
A. 此时水的离子积Kw=1×10-14 B. 水电离出的c(H+)=1×10-10molL-1
C. 水的电离程度随温度升高而增大 D. c(Na+)=c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3摩尔电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)_________L。
(2)反应②中_________作氧化剂,___________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____________。
(4)用单线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)。___________
Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
(5)反应③中氧化产物与还原产物的物质的量之比为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com