
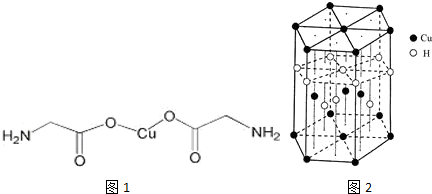
 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.
,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.分析 (1)Cu为29号元素,价电子排布为3d104s1;Cu原子最外层含有一个电子;同周期从左到右第一电离能增大,但是第VA和VIA族反常;
(2)根据价层电子对数=成键电子对数+孤电子对数判断;原子数相同、价电子数相同的微粒互为等电子体;
(3)-NH2中N原子的价层电子对数为4;
(4)CN-的结构式为[C≡N]-,三键中含有1个σ键与2个π键;
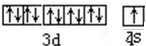
(5)利用均摊法确定其化学式,每个顶点上的原子被6个晶胞占有;
(6)先判断晶胞中所含微粒数,根据公式ρ=$\frac{m}{V}$计算得出.
解答 解:(1)铜是29号元素,价电子排布为3d104s1,则其价电子轨道表示式为: ;Cu原子最外层含有一个电子,第四周期中最外层只有1个电子的元素还有K Cr;同一周期中,元素的第一电离能随着原子序数的增大而增大,但第VA族元素的第一电离能大于其相邻元素,所以N、O元素第一电离能为O<N,
;Cu原子最外层含有一个电子,第四周期中最外层只有1个电子的元素还有K Cr;同一周期中,元素的第一电离能随着原子序数的增大而增大,但第VA族元素的第一电离能大于其相邻元素,所以N、O元素第一电离能为O<N,
故答案为: ;K Cr; O<N;
;K Cr; O<N;
(2)PO43-中P原子的价层电子对=4+$\frac{1}{2}$(5+3-4×2)=4,且不含孤电子对,所以其空间构型正四面体,根据原子数和价电子数分别相等的两种微粒互为等电子体,则PO43-的等电子体有SO42- ClO4-等
故答案为:正四面体;SO42- ClO4-;
(3))-NH2中N原子的价层电子对数成键电子对数+孤电子对数=3+1=4,所以N原子为sp3杂化;
故答案为:sp3;
(4)CN-的结构式为[C≡N]-,三键中含有1个σ键与2个π键,则CN--中含有的σ键与π键的数目之比为1:2,
故答案为:1:2;
(5)该晶胞中,铜原子个数=3+2×$\frac{1}{2}$+12×$\frac{1}{6}$=6,H原子个数=1+3+6×$\frac{1}{3}$=6,所以其化学式为CuH,
故答案为:CuH;
(6)铜晶体为面心立方最密堆积,则每个晶胞中含有铜的原子:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cu原子半径为rpm=r×10-10cm,假设晶体铜的密度为ρ,晶胞的边长为d,$\sqrt{2}$d=4r,d=2$\sqrt{2}$r,则晶胞的体积是d3,则ρ•d3=$\frac{4×64}{{N}_{A}}$,所以ρ=$\frac{256}{(2\sqrt{2}×r×1{0}^{-10})^{3}{N}_{A}}$g/cm3,
故答案为:$\frac{256}{(2\sqrt{2}×r×1{0}^{-10})^{3}{N}_{A}}$.
点评 本题考查了物质结构及性质,涉及电子排布、第一电离能、微粒空间构型的判断、等电子体、杂化理论的应用、晶胞的计算等,题目难度中等,这些知识点都是考查热点,难点是化学式的确定,注意该题中每个顶点上的原子被6个晶胞占有而不是8个晶胞占有,为易错点.


科目:高中化学 来源: 题型:选择题
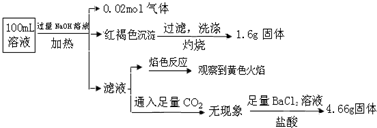
| A. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol•L-1 | |
| B. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| C. | SO42-、NH4+、Na+一定存在,CO32-、Al3+一定不存在 | |
| D. | 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL0.1 mol•L-1的AlCl3溶液 | B. | 20mL0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30mL0.2 mol•L-1的KCl溶液 | D. | 100mL0.25 mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c( R2-)+c( HR- )=c( Na+ ) | |
| B. | 某溶液中只存在Cl-、OH-、NH4+、H+四种离子,则一定不存在下列关系:c( Cl- )>c( NH4+ )>c( H+ )=c( OH- ) | |
| C. | 某物质的溶液中由水电离出的c ( H+ )=1×10-amol•L-1,若a>7,则溶液的pH一定为14-a | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液中:2 c( OH- )+c( A- )=2 c( H+ )+c( HA ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
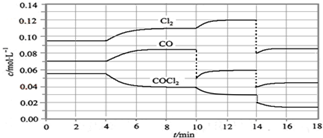
| A. | 从第10 min到第12 min时,生成Cl2的速率v(Cl2)=0.01 mol•L-1•min-1 | |
| B. | 第8 min时与第18 min时反应的平衡常数不相同 | |
| C. | 在第14 min时,改变的条件可能是压缩反应容器的体积 | |
| D. | CO在2-3min、12-13min和16-18min时平均反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | Y的基态原子核外P能级电子数比S能级少一个 |
| Z | 由Z形成的多种单质,其中之一是地球的“保护伞” |
| W | W的基态原子核外最外层只有1个电子,是人类社会最早使用的货币金属 |
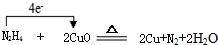 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
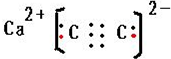 ;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).
;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
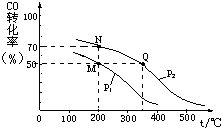 开发新能源和三废处理都是可持续发展的重要方面.
开发新能源和三废处理都是可持续发展的重要方面.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和C可形成一种含不同类型的化学键的碱性氧化物 | |
| B. | D2-离子在水溶液中与Al3+、H+均不能大量共存 | |
| C. | A2B的稳定性强于A2D的稳定性 | |
| D. | A2D和DB2可发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com