


科目:高中化学 来源: 题型:
| 实验内容 | 实验目的 | |
| ① | 分别测定0.01mol/L的HCl和H2S的c(H+) | 比较氯和硫的非金属性强弱 |
| ② | 混合气体通入盛有饱和碳酸氢钠溶液的洗气瓶 | 除去CO2中少量的SO2 |
| ③ | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
| ④ | 将硫酸铜晶体分别放入浓硫酸和稀硫酸中 | 鉴别浓硫酸和稀硫酸 |
| A、②④ | B、①③ | C、①② | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
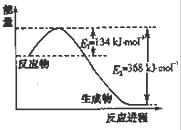
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
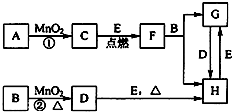 如图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物.它们存在如图所示的转化关系,反应中生成的次要产物均已略去.
如图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物.它们存在如图所示的转化关系,反应中生成的次要产物均已略去.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
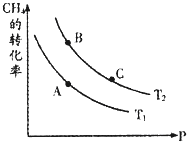 生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g)?CO(g)+3H2(g),试回答下列问题.
生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g)?CO(g)+3H2(g),试回答下列问题.| 3 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com