
| A. | 煤的气化、液化和石油的分馏均为物理变化 | |
| B. | 蛋白质水解生成氨基酸的反应属于取代反应 | |
| C. | 丙烷与氯气反应可得到沸点不同的4 种二氯代物 | |
| D. | 乙酸和硬脂酸(C17H35COOH)互为同系物 |
分析 A.煤的气化生成CO和氢气,液化生成甲醇;
B.蛋白质含-CONH-,可发生水解反应;
C.二氯代产物可以取代同一碳原子上的2个H原子,可以取代不同碳原子上的H原子;
D.乙酸和硬脂酸(C17H35COOH)均含1个-COOH,均符合CnH2nO2.
解答 解:A.煤的气化生成CO和氢气,液化生成甲醇,均为化学变化,而石油的分馏与混合物沸点有关,为物理变化,故A错误;
B.蛋白质含-CONH-,可发生水解反应生成氨基酸,属于取代反应,故B正确;
C.二氯代产物取代同一碳原子上的2个H原子,有2种:CHCl2CH2CH3、CH3CCl2CH3,取代不同碳原子上的H原子,有2种:CH2ClCHClCH3、CH2ClCH2CH2Cl,共有4种,故C正确;
D.乙酸和硬脂酸(C17H35COOH)均含1个-COOH,均符合CnH2nO2,结构相似,均为饱和一元羧酸,互为同系物,故D正确;
故选A
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意同系物的判断,题目难度不大.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:实验题
 某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.
某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )
X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )| A. | 简单离子的半径:W>Z>R | |
| B. | XR与XRZ均为强酸 | |
| C. | 化合物W2Z2中既含离子键又含极性键 | |
| D. | 图中转化过程发生的反应均为化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 氢化物沸点(℃) | -33.4 | 100 | 19.54 | -87.7 | -60.7 | -84.9 |
| 主要化合价 | +5 -3 | -2 | -1 | +5 -3 | +6 -2 | +7 -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
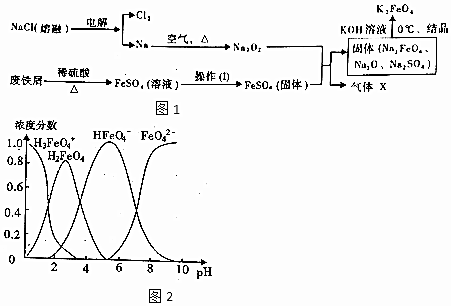
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
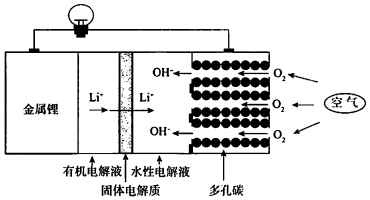
| A. | 回收水性电解液可制取锂 | |
| B. | 可将有机电解液改为水溶液 | |
| C. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| D. | 电池总反应方程式为4Li+O2+2H2O═4LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | W的最高价氧化物对应的水化物一定是强酸 | |
| B. | Z的单质一定能溶于稀硫酸中 | |
| C. | 四种元素的最高正化合价均等于其族序数 | |
| D. | 四种原子中,Z的原子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=2.0mol•L-1•min-1 | B. | v(B)=4.0mol•L-1•min-1 | ||
| C. | v(C)=0.1mol•L-1•s-1 | D. | v(D)=0.3mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com