
【题目】某厂废水中含5.00×10-3 mol·L-1的Cr2O![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价有+3,+2),设计了如下实验流程:
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价有+3,+2),设计了如下实验流程:

(1)第①步反应的离子方程式是__________________________________________
(2)第②步中用pH试纸测定溶液pH的操作是______________________________
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为______________,加碱调节至pH为________时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是______________________,原因是________________________________________________。
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
【答案】Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O 将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照 Fe3+ 2.7 6 Zn2+和Fe2+分离不开 Fe(OH)2和Zn(OH)2的Ksp相近
【解析】
(1)第①步主要是重铬酸根和亚铁离子反应生成铬离子和铁离子,其反应的离子方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
(2)第②步中用pH试纸测定溶液pH的操作是将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁在稀硫酸双氧水作用下变为Fe3+,![]() ,c(OH-) = 5×10-12mol·L-1,c(H+) = 2×10-3mol·L-1,pH = 2.7,因此加碱调节至pH为2.7时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱,
,c(OH-) = 5×10-12mol·L-1,c(H+) = 2×10-3mol·L-1,pH = 2.7,因此加碱调节至pH为2.7时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱,![]() ,c(OH-) = 1×10-8mol·L-1,c(H+) =1×10-6mol·L-1,pH = 6,因此pH为6时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近,不能分离开。
,c(OH-) = 1×10-8mol·L-1,c(H+) =1×10-6mol·L-1,pH = 6,因此pH为6时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近,不能分离开。
(1)第①步主要是重铬酸根和亚铁离子反应生成铬离子和铁离子,其反应的离子方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
(2)第②步中用pH试纸测定溶液pH的操作是将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照,故答案为:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁在稀硫酸双氧水作用下变为Fe3+,![]() ,c(OH-) = 5×10-12mol·L-1,c(H+) = 2×10-3mol·L-1,pH = 2.7,因此加碱调节至pH为2.7时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱,
,c(OH-) = 5×10-12mol·L-1,c(H+) = 2×10-3mol·L-1,pH = 2.7,因此加碱调节至pH为2.7时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱,![]() ,c(OH-) = 1×10-8mol·L-1,c(H+) =1×10-6mol·L-1,pH = 6,因此pH为6时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近,不能分离开,故答案为:Fe3+; 2.7;6;Zn2+和Fe2+分离不开;Fe(OH)2和Zn(OH)2的Ksp相近。
,c(OH-) = 1×10-8mol·L-1,c(H+) =1×10-6mol·L-1,pH = 6,因此pH为6时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近,不能分离开,故答案为:Fe3+; 2.7;6;Zn2+和Fe2+分离不开;Fe(OH)2和Zn(OH)2的Ksp相近。


科目:高中化学 来源: 题型:
【题目】常温下,将0.2mol/LKMnO4酸性溶液0.1L与一定量pH=3的草酸(HOOC—COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molHOOC—COOH含共用电子对数目为0.9NA
B.当1molKMnO4被还原时,强酸提供的H+数目为NA
C.pH=3的草酸溶液含有H+数目为0.001NA
D.该反应释放CO2分子数目为![]() NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有硫酸铁、硫酸亚铁和硫酸混合溶液200mL,现将其分成两等份,往其中一份中滴加足量BaCl2溶液,产生25.63g白色沉淀,往另一份中投入足量铁片,放出1.12L气体(标准状况)。下列判断错误的是( )
A.原溶液中离子有3c(Fe3+)+c(H+)+2c(Fe2+)=2c(SO42-)+c(OH-)
B.原混合液中c(Fe3+)可能为0.1molL-1
C.原混合液中c(H+)=0.5molL-1
D.溶解的铁最多不超过3.92g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某氨水中加入醋酸溶液,反应方程式如下:NH3·H2O+CH3COOH=CH3COONH4+H2O滴加过程,溶液的导电能力(I)与加入醋酸溶液的体积(V)关系正确的是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答:
(1)常温下,pH=2的醋酸和pH=12的氢氧化钠等体积混合,混合后溶液呈_____性
(2)25℃时,柠檬水的pH是3,其中氢氧根离子浓度是_______mol/L
(3)已知下列反应:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1= -akJ/mol
②C(s)+O2(g)=CO2(g) △H2= -bkJ/mol
则反应2C(s)+2H2O(l) =CH3COOH(l)的反应热为△H=_____________kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验过程如图所示:则图③的试管中的现象是
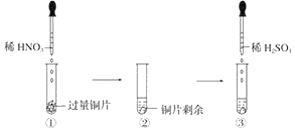
A. 无明显现象,因稀硫酸不与铜反应
B. 铜片溶解,产生无色气体,该气体遇到空气不变色
C. 铜片溶解,放出红棕色有刺激性气味的气体
D. 铜片溶解,产生无色气体,该气体在试管口变为红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下不能实现的是
①S![]() SO3
SO3![]() H2SO4
H2SO4
②N2![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
③MgCl(aq)![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
④Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
⑤铝土矿![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)2
Al(OH)2![]() Al2O2
Al2O2![]() Al
Al
A.①③⑤
B.②③④
C.③④⑤
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置Ⅰ为新型电池,放电时B电极的反应式为NaBr3+2Na++2e-=3NaBr,装置Ⅱ为铅蓄电池。首先闭合K1和K2,当铅蓄电池充电结束后,断开K1,闭合K2。下列说法正确的是

A.装置Ⅰ放电时的A电极反应式为2Na2S2-2e-=Na2S4+2Na+
B.闭合K1、K2时,每有0.1molNa+通过离子交换膜,装置Ⅱ溶液中有0.1mol电子转移
C.断开K1、闭合K2时,b电极的电极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O
D.断开K1、闭合K2时,装置Ⅱ中SO42-向a电极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,计算下列溶液的pH,并将计算结果填在横线上:
(1)c(OH-)=1×10-4mol·L-1的溶液_______________。
(2)将0.1 mol HCl溶于水制成100 mL溶液______________。
(3)将pH=2的HCl溶液和pH=2的H2SO4溶液以体积比3∶1混合_____________。
(4)将0.23 g金属钠溶于水并配制成100 mL的溶液_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com