
| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 0.01×0.03 |
| 0.01×0.05 |


科目:高中化学 来源: 题型:
| A、刚充人时反应速率:v(正)减小,v(逆)增大 |
| B、达到新的平衡时:反应混合物中A、B的物质的量分数不变 |
| C、达到新的平衡时:c(A):c(B):c(C)仍为1:1:2 |
| D、达到新的平衡过程中:体系压强先增大,后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度 |
| B、加入NH4Cl固体 |
| C、通入HCl气体 |
| D、加入1mol/LNaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
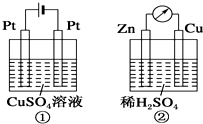 如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A、产生气体的体积:①>② |
| B、溶液的pH变化:①增大,②减小 |
| C、电极上析出固体物质的质量:①>② |
| D、电极反应式:①的阴极:Cu2++2e-═Cu,②的负极:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
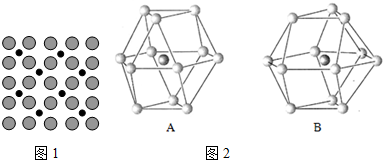
| N |
| Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com