
下列电子排布图能表示氮原子的最低能量状态的是( )
A. B.
B.
C. D.
D.
科目:高中化学 来源:2016届吉林省高一上学期期末质量检测化学试卷(解析版) 题型:选择题
废切削液中含2%—5%的NaNO2,直接排放会造成环境污染,下述试剂中能使其转化为无污染的N2的是
A. H2O2 B. NH4Cl C. NaCl D. 浓H2SO4
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
Li-A1/FeS电池是一种正在开发的车载电池,该电池中正极电极反应式为:2Li++FeS+2e- =Li2S+Fe。有关该电池的叙述正确的是( )
A.该电池的总反应式为:2Li+FeS=Li2S+Fe
B.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
C.负极的电极反应式为Al-3e-=Al3+
D.充电时,阴极的电极反应式为:Li2S+Fe-2e- = 2Li++FeS
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:选择题
元素周期律和元素周期表是学习化学的重要工具,下列叙述不正确的是( )
A.从左到右,元素周期表中的第13列为ⅢA族
B.某ⅡA族元素的原子序数为x ,则与它同周期的ⅢA族元素的原子序数可能为x+25
C.ⅥA族元素,随原子半径增大,对应气态氢化物的稳定性逐渐增强
D.53号元素位于周期表P区、第五周期ⅦA族。
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:选择题
根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )
A、离子半径:S2->Cl->Ca2+ B、原子半径:Ca>S>Cl
C、酸性:HClO4<HBrO4<HIO4 D、热稳定性:HCl>H2S>H2Se
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高二下学期第一次月考化学试卷(解析版) 题型:实验题
(12分)溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。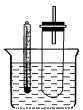
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL溴乙烷,振荡。
实验操作Ⅱ:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是 ;试管口安装一长导管的作用是 。
(2)鉴定生成物中乙醇的结构,可用的波谱是 , 。
(3)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是 ,检验的方法是 (需说明所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是( )
A.甲苯的硝化反应生成三硝基甲苯
B.甲苯能使酸性高锰酸钾溶液褪色
C.甲苯燃烧产生带浓烟的火焰
D.1mol甲苯与3mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH― 四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③ a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:填空题
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。

(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)。
(5)10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量。
(6)能说明该反应已经达到平衡状态的是( )
a. v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.恒容容器内物质的密度保持不变
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是( )
a.及时分离出SO3气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com