
【题目】下列解释事实的离子方程式不正确的是( )
A.铝片放入NaOH溶液中有气体产生:2Al+2OH﹣+2H2O=2AlO2+3H2↑
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:Cr2O72(橙色)+H2O2CrO42(黄色)+2H+
C.向Na2SiO3溶液中通入过量CO2制备硅酸凝胶:SiO32- +CO2+H2O=H2SiO3(胶体)+ CO32-
D.用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4+CO32-![]() CaCO3+SO42-
CaCO3+SO42-
【答案】C
【解析】
A.铝片放入NaOH溶液发生反应生成偏铝酸钠和氢气,离子反应为:2Al+2OH﹣+2H2O=2 AlO2+3H2↑,故A正确;
B.K2Cr2O7溶液中存在Cr2O72(橙色)+H2O2CrO42(黄色)+2H+,滴加少量浓H2SO4,增大氢离子浓度,平衡逆向移动,颜色加深,故B正确;
C.碳酸的酸性强于硅酸,向Na2SiO3溶液中通入过量CO2制备硅酸凝胶,符合强酸制取弱酸,二氧化碳过量时,生成碳酸氢根离子,离子反应方程式为:SiO32-+2CO2+2H2O=H2SiO3(胶体)+2HCO3-,故C错误;
D.碳酸钙溶解度小于硫酸钙,碳酸钠与硫酸钙反应生成碳酸钙和硫酸钠,离子方程式:CaSO4+CO32-![]() CaCO3+SO42-,故D正确;
CaCO3+SO42-,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列反应中不是氧化还原反应的是( )
A.3Cl2+6KOH=5KCl+KClO3+3H2O
B.CuO+H2![]() Cu+H2O
Cu+H2O
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量的硫酸溶液中加入200mL 0.4mol/L 的Ba(OH)2溶液,放出10.24kJ的热量。向足量的Ba(OH)2溶液中加入200mL 0.4mol/L 的HCl溶液,放出2.2kJ的热量。则硫酸钠溶液和氯化钡溶液反应的离子的热化学方程式为
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -2.92 kJ/mol
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -18 kJ/mol
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -0.72 kJ/mol
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -73 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液。然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。方案如下:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,该反应的离子方程式为______________________,每消耗1 mol H2C2O4转移_____mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·s-1。
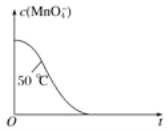
(4)已知50 ℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4-)~t的变化曲线示意图。_____________
(5)有同学做实验时发现,酸性高锰酸钾溶液与草酸溶液反应开始时,溶液褪色慢,但过了一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出以下的猜想。
猜想a:酸性高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快。
猜想b:________________________________________。
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是__________
A硫酸钾 B硫酸锰 C二氧化锰 D水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g)。测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,下列数据可能存在的是( )
2SO3(g)。测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,下列数据可能存在的是( )
A. SO2、O2浓度分别为0.4 mol·L-1、0.2 mol·L-1
B. SO3浓度为0.25 mol·L-1
C. SO3浓度为0.4 mol·L-1
D. SO3、SO2浓度均为0.15 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)═H2O(l) △H=﹣285.8kJmol﹣1
O2(g)═H2O(l) △H=﹣285.8kJmol﹣1
②H2(g)+![]() O2(g)═H2O(g) △H=﹣241.8kJmol﹣1
O2(g)═H2O(g) △H=﹣241.8kJmol﹣1
③C(s)+![]() O2(g)═CO(g) △H=﹣110.5kJmol﹣1
O2(g)═CO(g) △H=﹣110.5kJmol﹣1
④CO2(g)═C(s)+O2(g) △H=+393.5kJmol﹣1
回答下列各问题:
(1)上述反应中属于放热反应的是___。
(2)H2的燃烧热为___;C的燃烧热为___。
(3)燃烧10gH2生成液态水,放出的热量为___。
(4)CO燃烧的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
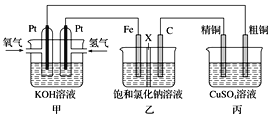
(1)通入氢气的电极为________ (填正极或负极),该电极反应式为________。
(2)石墨电极为________ (填阳极或阴极),乙中总反应化学方程式为________;如果把铁电极和石墨电极交换,乙溶液左侧出现的现象是_________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01mol O2,丙中精铜增重_________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.基态Cr原子有6个未成对电子
B.PH3和NH3分子中均含有孤电子对,且PH3提供孤电子对的能力强于NH3
C.BeO的晶格能大于MgO,可推测BeCO3的分解温度低于MgCO3
D.向1mol配合物![]() 中加入足量AgNO3溶液,可以得到3molAgCl沉淀
中加入足量AgNO3溶液,可以得到3molAgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取无水氯化铜的实验装置图,将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:

(1)盛放浓盐酸的仪器名称为__。
(2)烧瓶中发生反应的离子方程式为__。
(3)C瓶中的试剂是__,其作用是__。
(4)玻璃管D中发生反应的化学方程式是__,反应现象是__。
(5)干燥管E中盛有碱石灰(CaO+NaOH),其作用是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com