
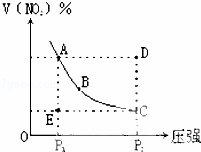
对于反应N2O4⇌2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).下列说法正确的是( )
|
| A. | A、C两点的正反应速率的关系A>C |
|
| B. | A、B、C、D、E各状态,V正<V逆的是状态E |
|
| C. | 维持P1不变,E→A所需时间为x,维持P2不变,D→C所需时间为y,则x<y |
|
| D. | 使E状态从水平方向到达C状态,从理论上来讲,可选用的条件是从P1突然加压至P2 |
| 化学平衡建立的过程. | |
| 专题: | 化学平衡专题. |
| 分析: | A、根据压强对化学反应速率的影响分析,压强越大,反应速率越大; B、处于曲线上的状态为平衡状态,在曲线以外的状态不处于平衡状态,根据从坐标的变化趋势判断反应进行的方向; C、根据压强对化学反应速率的影响分析,压强越大,反应速率越大,达到平衡状态时用的时间越少; D、从p1突然加压至p2,瞬间平衡没有移动,NO2的体积分数不变,再缓慢降压时,平衡向正反应方向移动,NO2的体积分数逐渐增大. |
| 解答: | 解:A、增大压强,反应速率增大,C点压强大于A点压强,所以v(A)<v(C),故A错误; B、处于曲线上的状态为平衡状态,E点NO2的物质的量少于平衡状态时的物质的量,反应应向生成NO2的方向移动,此时v(正)>v(逆),D点NO2的物质的量多于平衡状态时的物质的量,反应向逆反应方向移动,此时v(正)<v(逆),故B错误; C、压强越大,反应速率越大,达到平衡状态时用的时间越少,E→A和D→C的物质的量相等,应为x>y,故C错误; D、从p1突然加压至p2,瞬间平衡没有移动,NO2的体积分数不变,再缓慢降压时,平衡向正反应方向移动,NO2的体积分数逐渐增大,故D正确. 故选D. |
| 点评: | 本题考查化学平衡移动图象问题,题目难度中等,本题注意把握曲线的含义,以此判断反应进行方向. |


科目:高中化学 来源: 题型:
下列实验对应的结论不正确的是
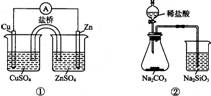
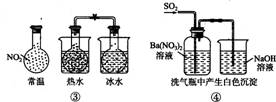
A.①能组成Zn-Cu原电池 B.②能证明非金属性Cl>C>Si
C.③能说明2NO2 N2O4 △H<0 D.④中自色沉淀为BaSO4
N2O4 △H<0 D.④中自色沉淀为BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
锑(Sb)在自然界中一般以硫化物的形式存在,我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般先在高温下将硫化物转化为氧化物,再用碳还原:关于反应①、②的说法正确的是( )
①2Sb2S3+3O2+6Fe Sb4O6+6FeS,
Sb4O6+6FeS,
②Sb4O6+6C 4Sb+6CO↑.
4Sb+6CO↑.
|
| A. | 反应①、②中的氧化剂分别是Sb2S3、Sb4O6 |
|
| B. | 反应①中每生成3molFeS时,共转移6 mol电子 |
|
| C. | 反应②说明高温下Sb的还原性比C强 |
|
| D. | 每生成4 molSb时,反应①与反应②中还原剂的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯水的说法正确的是( )
|
| A. | 向氯水中通入少量二氧化硫,氯水的漂白性增强 |
|
| B. | 氯水中加入NaCl固体,对溶液的pH无影响 |
|
| C. | 常温下,pH=2的氯水中:c(Cl﹣)+c(ClO﹣)+c(OH﹣)=0.01mol/L |
|
| D. | 向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3﹣═2CO2↑+Cl﹣+ClO﹣+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体.有关物质间的转化关系如下(图中部分反应物或产物已省略):
请填空
(1)B的电子式 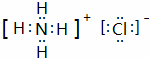 ,B物质的水溶液呈 酸性 ,原因是 NH4++H20⇌NH3.H2O+H+ (用离子方程式表示)
,B物质的水溶液呈 酸性 ,原因是 NH4++H20⇌NH3.H2O+H+ (用离子方程式表示)
(2)反应①的离子反应方程式为 Mg+2NH4+=Mg2++2NH3↑+H2↑
(3)操作a必须在HCl气流中加热得无水物,其原因是 抑制Mg2+的水解 ;操作b为 熔融状态下电解
(4)K+G+F→L写出该反应的化学方程式 4NO2+O2+2H2O=4HNO3 ,
(5)已知C的燃烧热为286KJ/mol,请写出表示1g C在F中完全燃烧生成液体G的热化学反应方程式 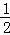 H2(g)+
H2(g)+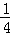 O2(g)=
O2(g)=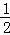 H2O(l)△H=﹣143kJ/mol .
H2O(l)△H=﹣143kJ/mol .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
|
| A. | 铁制品上电镀锌时,理论上电镀液ZnCl2需要不断更换 |
|
| B. | 钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 |
|
| C. | 甲烷燃料(KOH)电池的正极反应为:O2+2H2O+4e﹣=4OH﹣ |
|
| D. | 粗铜精炼过程中,电路中每通过2mol电子,阳极就会溶解64g铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
电化学与生产生活密切相关.请运用相关知识回答下列问题:
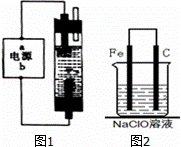
(1)如图1为某同学设计的装置,用石墨作电极电解饱和氯化钠溶液制备家用环保型消毒液(NaClO溶液)发生器.
若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,
则电源的a电极名称为 极(填“正”、“负”、“阴”或“阳”),
装置溶液中反应生成NaClO的离子方程式为: .
(2)该消毒液还具有的化学性质是 (填序号).
A.强氧化性 B.强还原性 C.不稳定性 D.漂白性E.弱酸性
(3)设计方案,对该消毒液对碳钢制品的腐蚀原理实施探究.
①用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段时间.预期的实验现象是 .
②为了进一步探究铁钉在该漂白剂(NaClO)溶液中的腐蚀原理,现设计了如图2实验装置,请写出碳(C)极上发生的电极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
丙酮醛(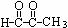 )是重要的制药中间体,如果以2-溴丙烷为初始原料,通过多步反应制得。需要经过的反应依次是( )
)是重要的制药中间体,如果以2-溴丙烷为初始原料,通过多步反应制得。需要经过的反应依次是( )
A.取代-氧化-加成-消去 B.消去-取代-加成-氧化
C.消去-加成-取代-氧化 D.取代-消去-加成-氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com