


科目:高中化学 来源: 题型:
| A、铁锈的形成一定发生了氧化还原反应 |
| B、复分解反应都不是氧化还原反应 |
| C、燃烧都是放热反应,也都是氧化还原反应 |
| D、分解反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2中 |
| B、SO2和SO3中 |
| C、SO2和O2中 |
| D、SO2、SO3和O2中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
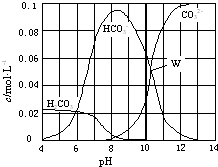 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A、W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
| B、pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol?L-1 |
| C、pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| D、pH=11的溶液中:c(Na+)+c (H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2 的摩尔质量是64 g |
| B、常温常压下,64 g SO2 中所含的分子数为6.02×1023 个 |
| C、1 mol SO2 的质量是64 g/mol |
| D、常温常压下,1 mol SO2 的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样3.52克置于铂舟并放入燃烧管中,不断通入氧气流.用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重1.44克和5.28克,生成物完全被吸收.试回答以下问题:
某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样3.52克置于铂舟并放入燃烧管中,不断通入氧气流.用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重1.44克和5.28克,生成物完全被吸收.试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c?H2? |
| c?CH3OH? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com