
【题目】25 ℃时,分别向20.00 mL 0.100 0 mol·L-1的氨水、醋酸铵溶液中滴加0.100 0 mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法错误的是( )
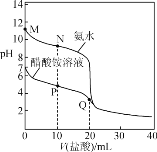
A.氨水的电离平衡常数的数量级约是10-5
B.N点:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P点:c(NH4+)<2c(CH3COO-)+c(NH3·H2O)
D.Q点:2c(Cl-)=c(CH3COOH)+c(NH4+)
【答案】D
【解析】
浓度为0.100 0 mol·L-1的氨水显碱性,浓度为0.100 0 mol·L-1的醋酸铵溶液显中性。
A选项,0.100 0 mol·L-1的氨水pH值为11,c(NH4+)=c(OH-) = 1×10-3 mol·L-1,氨水的电离平衡常数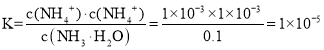 ,其数量级约是10-5,故A正确;
,其数量级约是10-5,故A正确;
B选项,N点溶质为氯化铵和氨水的混合物且浓度相等,溶液显碱性,说明氨水电离程度大于NH4+水解程度,因此浓度大小为:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-),故B正确;
C选项,P点溶质是醋酸铵、醋酸和氯化铵,溶液显酸性,根据电荷守恒:c(CH3COO-)+c(OH-)+c(Cl-)=c(NH4+)+c(H+),溶液呈酸性:c(OH-) < c(H+),因此浓度有:c(NH4+) < c(Cl-) +c(CH3COO-),根据物料守恒得到:2c(Cl-)=c(NH3·H2O)+c(NH4+),两者变形得到c(NH4+) < c(NH3·H2O) +2c(CH3COO-),故C正确;
D选项,Q点溶质为等物质的量的醋酸和氯化铵,根据物料守恒得出:2c(Cl-)=c(NH3·H2O)+c(NH4+)+c(CH3COOH)+c(CH3COO-),故D错误。
综上所述,答案为D。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,最终的白色沉淀不一定是BaSO4的是( )
A.Fe(NO3)2溶液![]()
![]()
![]() 白色沉淀
白色沉淀
B.Ba(NO3)2溶液![]()
![]() 白色沉淀
白色沉淀
C.无色溶液![]()
![]() 白色沉淀
白色沉淀
D.无色溶液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉花香气成分有多种,乙酸苯甲酯(![]() )是其中一种,它可以从茉莉花中提取,也可用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中一种,它可以从茉莉花中提取,也可用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
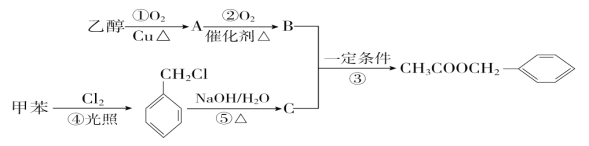
(1)B的结构简式分别为___;反应⑤的反应类型分别为___。
(2)写出反应①、③的化学方程式:
①____;
③____。
(3)反应___(填序号)原子的理论利用率为100%,符合“绿色化学”的要求。
(4)符合下列条件的乙酸苯乙酯的同分异构体的数目有___个
I、能发生银镜反应 II、能发生水解反且水解产物能与FeCl3溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一个容积为1L的密闭容器中,充入1molH2(g)和1mol I2(g),发生反应H2(g)+I2(g)![]() 2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g),则下列判断正确的是( )
I2(g),则下列判断正确的是( )
A.后一反应的平衡常数为1
B.后一反应的平衡常数为0.5
C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1
D.后一反应达到平衡时,HI(g)的平衡浓度0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的A、B、C、D、E、F、G均为有机物。
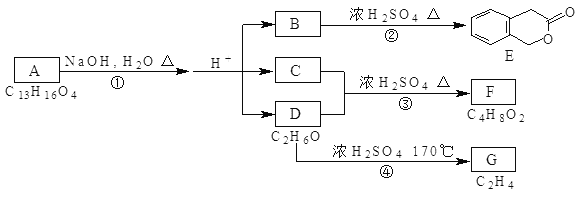
据上图回答问题:
(1)D的名称为:___;
(2)A的结构简式是___;
(3)反应③的化学方程式是:___;
(4)符合下列3个条件的B的同分异构体的数目有___个;
I、含有二取代苯环结构 II、与B有相同官能团 III、不与FeCl3溶液发生显色反应。写出其中属于邻二取代苯环结构的任意一个同分异构体的结构简式___;
(5)B不仅可以生成E,还可以在一定条件下形成高分子化合物,写出B形成高分子化合物的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]() B. Na+的结构示意图:
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
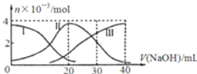
A.滴加过程中当溶液呈中性时,![]()
B.当![]() 时,则有:
时,则有:![]()
C.H![]() 在水中的电离方程式是:H
在水中的电离方程式是:H![]() ;
;![]()
D.当![]() 时,则有:
时,则有:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是
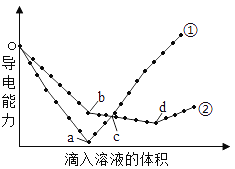
A.b→d反应的离子方程式为:H++OH-=H2O
B.o→a反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.c点导电能力相同,所以两溶液中含有相同量的OH–
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com