
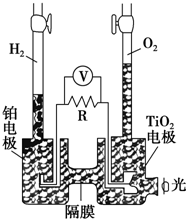
 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )| A. | 该装置只能将光能转化为电能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变小 |
分析 该装置中是将光能转化为电能,然后通过电解将电能转化为化学能,根据装置图可知,铂电极为阴极,电极反应式为2H++2e-═H2↑,二氧化钛电极为阳极,电极反应式为4OH--4e-=O2↑+2H2O,据此分析解答.
解答 解:A.该装置中是将光能转化为电能,再电解稀硫酸溶液,电能转化为化学能,故A错误;
B.该装置中TiO2电极上生成氧气,说明该电极上失电子发生氧化反应,电极反应式为4OH--4e-=O2↑+2H2O,铂电极为阴极,电极反应式为2H++2e-═H2↑,故B错误;
C.该装置工作时,Pt作阴极、二氧化钛作阳极,阳极上失电子、阴极上得电子,所以电流由铂电极经R流向TiO2电极,故C错误;
D.二氧化钛电极为阳极,电极反应式为:2H2O-4e-=4H++O2↑,TiO2电极附近溶液的pH变小,故D正确;
故选D.
点评 本题考查电解原理,关键是根据两极得到的气体判断电极,理解掌握电极判断方法与电解工作原理,旨在考查学生对基础知识的迁移应用.


科目:高中化学 来源: 题型:解答题
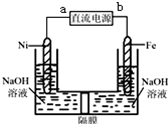 Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图所示,请根据图示分析:电解过程中的电池反应为Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;每转移0.6mol电子在Ni电极上产生的气体在标况下的体积为6.72L;隔膜用阳离子交换膜(只允许阳离子通过)还是阴离子交换膜(只允许阴离子通过)阳离子交换膜.
Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图所示,请根据图示分析:电解过程中的电池反应为Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;每转移0.6mol电子在Ni电极上产生的气体在标况下的体积为6.72L;隔膜用阳离子交换膜(只允许阳离子通过)还是阴离子交换膜(只允许阴离子通过)阳离子交换膜.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaAlO2溶液中通入过量CO2:AlO2-+4CO2+2H2O═Al3++4HCO3- | |
| B. | Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-═CaCO3↓+2HClO | |
| C. | 用Fe(NO3)2溶液加入HCl溶液:Fe2++NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | FeBr2溶液通入少量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
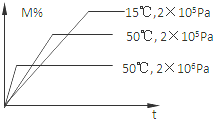 在密闭容器中进行反应:M(g)+N(g)?R(g)+2L,此反应符合下图关系,该反应是下列哪种情况( )
在密闭容器中进行反应:M(g)+N(g)?R(g)+2L,此反应符合下图关系,该反应是下列哪种情况( )| A. | 正反应吸热,L是固体或液体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应放热,L是固体或液体 | D. | 正反应放热,L是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和C可能都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B是固体和C是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每一个反应,在一个温度下,有一个K值 | |
| B. | K越大,表示正向反应的倾向大,反应完全 | |
| C. | K值只能说明反应的最大限度,不能说明反应的速度 | |
| D. | 吸热反应的K值大于所有放热反应的K值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致 | |
| B. | 乙烯可作为水果的催熟剂 | |
| C. | 葡萄糖、油脂、蛋白质等进入人体内经水解后被吸收 | |
| D. | 使用漂白液时不可与酸性洁厕剂混用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com