


科目:高中化学 来源: 题型:
| A、ag | ||
| B、2ag | ||
C、
| ||
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:1:1:1 |
| B、2:2:2:1 |
| C、1:2:2:1 |
| D、缺少条件,无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
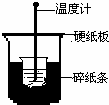 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
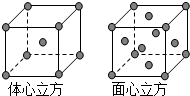 利用有关知识回答下列问题:
利用有关知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应温度必须控制在170℃ |
| B、反应物是乙醇和过量的3mol/L硫酸的混合液 |
| C、温度计应插入反应溶液液面以下 |
| D、反应容器中应加入少许瓷片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
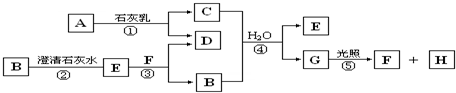
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升温 |
| B、加水 |
| C、加入NaOH溶液 |
| D、加入0.1mol/L HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com