
(17分) 氯碱厂电解饱和食盐水制取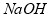 的工艺流程示意图如下:
的工艺流程示意图如下:
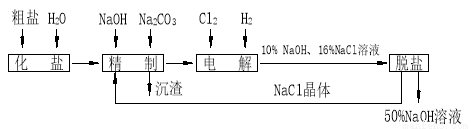
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为_________________________________;与电源负极相连的电极附近,溶液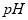 值___________。(选填:不变、升高或下降)
值___________。(选填:不变、升高或下降)
(2)工业食盐含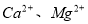 等杂质,精制过程发生反应的离子方程式为____________________________________________;
等杂质,精制过程发生反应的离子方程式为____________________________________________;
(3)如果粗盐中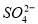 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去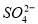 ,该钡试剂可以是________(选填a、b、c多选倒扣分)
,该钡试剂可以是________(选填a、b、c多选倒扣分)
a. 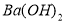 b.
b. 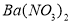 c.
c. 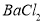
(4)为有效除去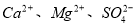 ,加入试剂的合理顺序为_____________(选填a、b、c多选倒扣分)
,加入试剂的合理顺序为_____________(选填a、b、c多选倒扣分)
a. 先加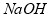 ,后加
,后加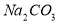 ,再加钡试剂
,再加钡试剂
b. 先加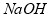 ,后加钡试剂,再加
,后加钡试剂,再加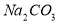
c. 先加钡试剂,后加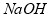 ,再加
,再加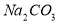
(5)脱盐工序中利用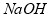 和
和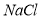 在溶解度上的差异,通过____________、冷却、______________(填写操作名称)除去
在溶解度上的差异,通过____________、冷却、______________(填写操作名称)除去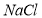 。
。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止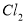 与
与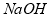 反应;采用无隔膜电解冷的食盐水时,
反应;采用无隔膜电解冷的食盐水时,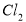 与
与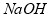 充分接触,产物仅是
充分接触,产物仅是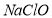 和
和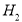 ,相应的化学方程式为_____________________。
,相应的化学方程式为_____________________。
(17分)(1)2Cl--2e-=Cl2↑,升高;
(2)Ca2++CO32-=CaCO3↓
Mg2++2OH-=Mg(OH)2↓
(3)a,c
(4)b,c
(5)蒸发,过滤
(6)NaCl+H2O H2↑+NaClO
H2↑+NaClO
或2NaCl+2H2O 2NaOH+H2↑+Cl2↑ , Cl2↑+2NaOH=NaCl+NaClO+H2O
2NaOH+H2↑+Cl2↑ , Cl2↑+2NaOH=NaCl+NaClO+H2O
【解析】
试题分析:(1)电解饱和食盐水中,与电源正极相连的是阳极,阳极发生氧化反应,所以是氯离子失去电子生成氯气,电极反应式为2Cl--2e-=Cl2↑;与电源负极相连的是阴极,发生还原反应,所以是氢离子在阴极放电生成氢气,是阴极附近的氢氧根离子浓度增大,溶液的pH升高;
(2)工业盐中的钙、镁离子用碳酸钠、氢氧化钠溶液除去,碳酸钠与钙离子反应生成碳酸钙沉淀,氢氧化钠与镁离子反应生成氢氧化镁沉淀,离子方程式为Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓
(3)硫酸根离子用钡试剂除去,可选择氢氧化钡或氯化钡溶液,不能选择硝酸钡溶液,因为过量的钡离子可用碳酸钠除去,碳酸根离子、氢氧根离子再用盐酸除去,而硝酸钡中的硝酸根离子无法除去,造成食盐不纯;
(4)根据以上分析,钙离子用碳酸钠除去,过量的碳酸根离子用盐酸除去,且硫酸根所用的钡试剂是过量的,而过量的钡离子也用碳酸钠除去,所以只要最后加入碳酸钠即可,答案选bc;
(5)根据氢氧化钠与氯化钠溶解度的不同,将溶液蒸发,冷却,析出的氯化钠过滤除去;
(6)根据题意电解饱和食盐水得到的氯气又与氢氧化钠溶液反应最终生成的氢气和次氯酸钠,所以化学方程式为NaCl+H2O H2↑+NaClO或2NaCl+2H2O
H2↑+NaClO或2NaCl+2H2O 2NaOH+H2↑+Cl2↑ , Cl2↑+2NaOH=NaCl+NaClO+H2O
2NaOH+H2↑+Cl2↑ , Cl2↑+2NaOH=NaCl+NaClO+H2O
考点:考查粗盐的提纯,试剂的判断,离子方程式的书写,饱和食盐水的电解方程式的书写,操作步骤的判断


科目:高中化学 来源:2015届福建省高三上学期半期联考化学试卷(解析版) 题型:选择题
下列各组单质中,前者在一定的条件下能将后者从其化合物中置换出来的是
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤C、Si
A.只有②④ B.只有①③
C.只有①②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一上学期半期联考化学试卷(解析版) 题型:选择题
纳米科技是21世纪经济发展的发动机。人们会利用纳米级(1~100 nm,1nm=10-9 m)粒子物质制造出更加优秀的材料和器件,使化学在材料、能源、环境和生命科学等领域发挥越来越重要的作用。下列分散系中分散质颗粒与纳米级粒子在直径上具有相同数量级的是
A.溶液 B.悬浊液 C.胶体 D.乳浊液
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
A~D是含同一元素的四种物质,它们相互之间有如图所示的转化关系,其中A是单质,D是氢氧化物,则A可能是( )

①Al ②Mg ③Fe ④Na
A.①③ B.①②③ C.①② D.②③④
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.共价化合物中可能含有离子键
B.Ca2+、K+、Cl-、S2-四种粒子的离子半径依次减小
C. Po、
Po、 Po、
Po、 Po三种原子的核外电子数分别为124、125、126
Po三种原子的核外电子数分别为124、125、126
D.第ⅥA族元素氧、硫、硒对应的氢化物H2O、H2S、H2Se的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三10月月考理综化学试卷(解析版) 题型:选择题
关于下图电化学装置中的电极名称、材料及反应均可能正确的是
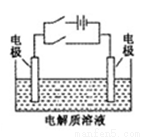
A.阴极(Cu片)2C1――2e-=Cl2↑
B.正极(石墨棒):Fe3+ +e-= Fe2+
C.阳极(Cu片):4OH――4e-=2H2O+O2↑
D.负极(Fe钉):Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三上学期第二次检测考试化学试卷(解析版) 题型:填空题
(8分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:

(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色
为 [25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三上学期第二次检测考试化学试卷(解析版) 题型:选择题
下列有关物质的性质及应用说法正确的是
A.过量的铜与浓硝酸反应可生成NO
B.Fe在O2中的燃烧产物可用于制红色涂料
C.Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到
D.Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三第一次诊断考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下11.2L Cl2溶于1L水中,转移电子的数目为0.5NA
B.将标准状况下22.4L NO与11.2L O2混合后的体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA
D.O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com