
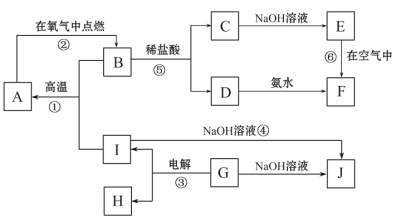
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为地壳中含量最多的金属元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)写出下列物质的化学式A_______________;G____________________;
(2)若C→D为化合反应,则此时的化学方程式_______________________________;
(3)写出E→F的化学方程式___________________________________________ ;
(4)写出反应④的离子方程式___________________________________________;
【答案】Fe Al2O3 2FeCl2+Cl2=2FeCl3 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
G为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明G为Al2O3,与NaOH反应生成NaAlO2,而I也能与NaOH反应生成NaAlO2,则I为Al,H为O2,C和碱反应生成E、F,D和气体K反应也生成E、F,则说明E、F都为氢氧化物,E能转化为F,应为Fe(OH)2→Fe(OH)3的转化,所以E为Fe(OH)2,F为Fe(OH)3,则C为FeCl2,D为FeCl3,B为Fe3O4,与Al在高温条件下发生铝热反应生成A,即Fe,则推断各物质分别为:A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,G为Al2O3,H为O2,为Al,结合物质的性质分析作答。
根据上述分析易知,
(1)A为Fe,G为Al2O3;
(2)C为FeCl2,D为FeCl3,若C→D为化合反应,则反应的化学方程式为:2FeCl2+ Cl2=2FeCl3;
(3)E为Fe(OH)2,F为Fe(OH)3,Fe(OH)2在空气中被氧化为Fe(OH)3,其化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)Al与NaOH溶液反应生成NaAlO2和H2的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑。


科目:高中化学 来源: 题型:
【题目】纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,其水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:_____。
(2)实验室中用过氧化氢制取氧气的化学方程式为____,当生成标准状况下1.12 L O2时,转移电子为___ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:___________。
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量。
①写出该反应的离子方程式____________。
②滴定到达终点的现象是____________。
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 19.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为____mol·L-1。
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果____(填“偏低”、“偏高”或“不变”)。
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不属于化合、分解、置换、复分解等四种基本反应类型的是( )
A.CuSO4+H2S=CuS↓ + H2SO4
B.2FeCl3+Cu=2FeCl2+CuCl2
C.Cu2(OH)2CO3 ![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI | 溶液变蓝色 | 氧化性:IO |
B | 向稀氨水和酚酞混合溶液中加入少量Ag2O,振荡 | 溶液由浅红色变为红色 | Ag2O是强碱 |
C | 向装有经过硫酸处理的CrO3(桔红色)的硅胶导管中吹入乙醇蒸气 | 固体逐渐由桔红色变为浅绿色(Cr3+) | 乙醇具有还原性 |
D | 向盛有少量水的烧杯中加入少量Mg2Si | 产生白色沉淀,液面上有火苗 | Mg2Si水解生成Mg(OH)2和SiH4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:
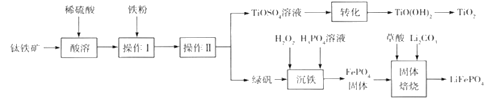
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
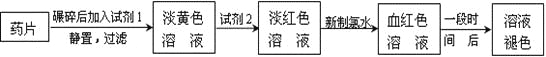
(1)试剂1是_______________________。
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是_______________________________________________________________。
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
编号 | 猜想 |
甲 | 溶液中的+3价Fe又被还原为+2价Fe |
乙 | 溶液中的SCN-被过量的氯水氧化 |
丙 | 新制的氯水具有漂白性,将该溶液漂白 |
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)
编号 | 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用胆矾(CuSO4·5H2O)配制1L0.1mol·L1 CuSO4溶液,正确的做法是( )
A.将胆矾加热除去结晶水后,称取16g溶于适量水中,然后将此溶液稀释至1L
B.将25g胆矾溶于少量水中,然后将此溶液稀释至1L
C.称取胆矾25g溶于1L水中
D.将16g胆矾溶于少量水中,然后将此溶液稀释至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程(如图),乙醛在两电极分别转化为乙醇和乙酸。下列对电解过程的分析正确的是

A. 以铅蓄电池为电源,则a极为Pb电极
B. 石墨Ⅱ电极附近的pH逐渐减小
C. 阳极反应为CH3CHO+H2O-2e-=CH3COOH+2H+
D. 每处理含8.8g乙醛的废水,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com