
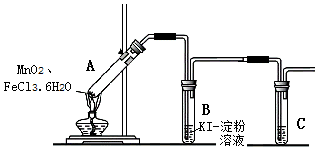
| 操作 | 现象 |
| (1)经检查,装置气密性良好. (2)添加药品,连接装置. (3)点燃酒精灯. | i.A中部分固体熔化,上方出现白雾; ii.稍后,产生黄色气体,管壁附着黄色液滴; iii.B中溶液变蓝. |
分析 【实验设计】A中制备氯气,B中氯气氧化KI,C中用氢氧化钠吸收氯气,防止污染空气;
【实验分析】(1)氯化铁水解生成HCl,受热逸出,据此分析;
(2)铁离子氧化碘离子生成亚铁离子和碘单质;检验铁离子用KSCN溶液;
(3)饱和氯化钠溶液吸收氯化铁蒸汽;
(4)MnO2与FeCl3•6H2O反应生成氯气、Fe2O3和MnCl2,物质的量之比为1:1,根据质量守恒可写;根据物质的水溶性分析;
【安全预案】阻止倒吸的操作是迅速拆下导气管.
解答 解:【实验设计】A中制备氯气,B中氯气氧化KI,则B中反应为:Cl2+2KI=2KCl+I2;C中用氢氧化钠吸收氯气,防止污染空气;
故答案为:Cl2+2KI=2KCl+I2;NaOH溶液;
【实验分析】(1)FeCl3•6H2O受热水解增强,生成HCl气体同时失去结晶水,HCl与H2O结合形成盐酸小液滴,故形成白雾;
故答案为:FeCl3•6H2O受热水解增强,生成HCl气体同时失去结晶水,HCl与H2O结合形成盐酸小液滴;
(2)铁离子氧化碘离子生成亚铁离子和碘单质,离子方程式为:2Fe3++2I-=2Fe2++I2;铁离子用KSCN溶液,将黄色气体通入B中的KSCN溶液,溶液变红,说明黄绿色气体中含有铁离子;
故答案为:2Fe3++2I-=2Fe2++I2;将黄色气体通入B中的KSCN溶液;
(3)饱和氯化钠溶液吸收氯化铁蒸汽,故可除去气体中的FeCl3;
故答案为:除去气体中的FeCl3;
(4)MnO2与FeCl3•6H2O反应生成氯气、Fe2O3和MnCl2,物质的量之比为1:1,则反应为:MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O;混合物为氯化锰和氧化铁的混合物,其中氯化锰溶于水,氧化铁不溶,故分离出Fe2O3的方法是:加足量水溶解,过滤,洗涤固体,干燥,即得Fe2O3;
故答案为:MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O;加足量水溶解,过滤,洗涤固体,干燥,即得Fe2O3;
【安全预案】已经开始发生倒吸,导管中含有溶液,取下小试管仍然会倒吸,移去酒精灯,温度降低,装置内压强减小,更容易发生倒吸,将A、B间的导管从乳胶管中取下,可以防止倒吸;
故答案为:c.
点评 本题考查物质性质探究实验,侧重对原理分析、陌生方程式的书写等考查,是对学生综合能力的考查,熟练掌握元素化合物性质.


科目:高中化学 来源: 题型:选择题
| A. | HCl+Zn,Zn+NaHSO4 | B. | Cu(OH)2+H2SO4,Cu(OH)2+HNO3 | ||
| C. | CaO+HCl,CaO+HNO3 | D. | BaCl2+NaHSO4,Ba(OH)2+NaHSO4(少量) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的分子式:CH3COOH | B. | 甲烷的结构简式:CH4 | ||
| C. | 35Cl表示该氯原子核内有20个中子 | D. | SiO2是二氧化硅的分子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
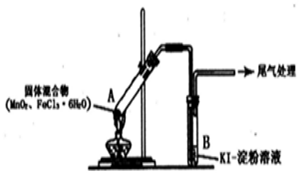
| 实验编号 | 操作 | 现象 |
| 实验1 | 按上图所示加热MnO2与FeCl3•6H2O 混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
| 实验2 | 把A中的混合物换为FeC13•6H2O,B中溶液换为KSCN溶液,加热. | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物X是烃类物质 | B. | 化合物X的实验式为CH4 | ||
| C. | 化合物X具有多种同分异构体 | D. | 可以确定化合物X的结构式 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl
,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl .
. 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某校化学小组用实验的方法进行探究影响化学反应速率的因素.
某校化学小组用实验的方法进行探究影响化学反应速率的因素.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L-1硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Al. | 反应速率:Al>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com