
【题目】将4mol A 气体和2mol B 气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g) B(g) 2C(g) 。若经 2s 后测得C 的浓度为 0.6mol·L-1,现有下列几种说法:
①用物质A 表示的反应平均速率为 0.3mol·L-1·s-1
②用物质B 表示的反应的平均速率为 0.6mol·L-1·s-1
③2s 时物质A 的转化率为 70%
④2s 时物质B 的浓度为 0.7mol·L-1
其中正确的是( )
A.①③B.①④C.②③D.③④
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】合成乙酸乙酯的路线如下:
CH2=CH2![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
请回答下列问题:
(1)写出乙烯的电子式_________________。
(2)C2H5OH、 CH3COOH分子中的官能团名称分别是____________、____________。
(3)写出下列反应的反应类型:①______________,②_____________。
(4)乙烯能发生聚合反应,其产物的结构简式为______________。
(5)写出下列反应的化学方程式:
反应②:________;
反应④:_________。
(6)实验室用如图装置制备乙酸乙酯:
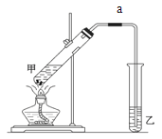
甲试管中碎瓷片的作用是______;导管a的作用是_______________;乙试管中饱和碳酸钠溶液的作用是:________ ; ________;该装置图中有一个明显的错误是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)相对分子质量为72且沸点最低的烷烃的结构简式为___
(2)写出有机物的键线式:![]() ___
___
(3)写出有机物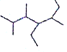 的名称___
的名称___
(4)写出甲基电子式:___,乙炔的结构式___
(5)某有机高分子化合物的结构片段如下:
![]()
则合成它的单体是(写结构简式)___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:

(1)上表的6种酸进行比较,酸性最弱的是:_____;HCOO-、S2-、HSO3-三种离子中,最难结合H+的是__________。
(2)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:_________。
(3)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:___。
(4)下列离子方程式书写正确的是________。
A.HNO2+HS-=NO2-+H2S↑
B.2HCOOH+SO32-=2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32-
D.H2SO3+SO32-=2HSO3-
E.H2C2O4+NO2-=HC2O4-+HNO2
(5)将少量的SO2通入Na2C2O4溶液,写出离子方程式___。
(6)已知HX为一元弱酸。HX的电离常数为5.5×10﹣8。某混合溶液中含有4molNaX、2molNa2CO3和1molNaHCO3。往溶液中通入3molCO2气体,充分反应后,气体全部被吸收,计算某些物质的量:Na2CO3______、NaHCO3______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两种微粒不属于同种元素原子的是![]()
A.M层全充满而N层为![]() 的原子和位于第四周期第IB族的原子
的原子和位于第四周期第IB族的原子
B.2p能级有一个空轨道的基态原子和最外层电子数是次外层电子数二倍的原子
C.价电子排布为![]() 的原子和原子序数为20的原子
的原子和原子序数为20的原子
D.3p能级有两个空轨道的基态原子和M层电子数为1的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 和
和![]() 溶于水后能导电,故KC
溶于水后能导电,故KC![]() 和
和![]() 为电解质
为电解质
B.![]() 时,
时,![]() 的盐酸和
的盐酸和![]() 的NaOH溶液等体积混合后,溶液为碱性
的NaOH溶液等体积混合后,溶液为碱性
C.![]() 的醋酸溶液加水稀释十倍后,溶液
的醋酸溶液加水稀释十倍后,溶液![]()
D.![]() 时,用浓度均为
时,用浓度均为![]() 的醋酸和盐酸溶液滴定等浓度NaOH溶液,二者pH突变范围相同
的醋酸和盐酸溶液滴定等浓度NaOH溶液,二者pH突变范围相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和二氧化碳在一定条件下可合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
I、在恒温条件下,分别将2 molCO2和6 mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(CH3OH)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(CH3OH)/mol | 0 | 0.50 | 0.80 | 0.90 | 0.99 | 1.00 | 1.00 |
(1)前10min中利用CO2表示的反应速率为____________。
(2)该温度下,此反应的平衡常数K=__________。
(3)该温度下,若向同容积的另一容器中投入的:CO2、H2、CH3OH、H2O的浓度分别为2 mol·L-1、2 mol·L-1、1 mol·L-1、1 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
Ⅱ、在密闭容器中充入1molCO2和3 mol H2,测得混合气体中甲醇的体积分数与温度的关系如图A所示:
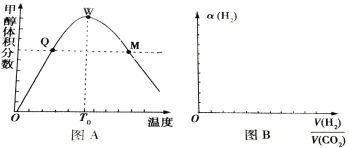
试回答下列问题:
(1)该反应是______(填“放热”或“吸热”)反应。
(2)氢气在Q点的转化率_________(填“大于”、“小于”或“等于”,下同)氢气在W点的转化率;
(3)解释0—T0内,甲醇的体积分数变化趋势:_______________。
(4)图B表示氢气转化率α(H2)与投料比![]() 的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.常温下,由水电离的c(H+)=10-13 mol·L-1的溶液中:Na+、NH4+、Cl-、HCO3-
B.酸性碘化钾溶液中滴加适量双氧水:2I— 2H+ H2O2=I2 2H2O
C.氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42—=BaSO4
D.向饱和碳酸钠溶液中通入二氧化碳:CO32— CO2 H2O=2HCO3—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com