
【题目】某工程师为了从使用过的腐蚀废液中回收铜,并重新获得![]() 溶液,准备采用如图步骤:
溶液,准备采用如图步骤:
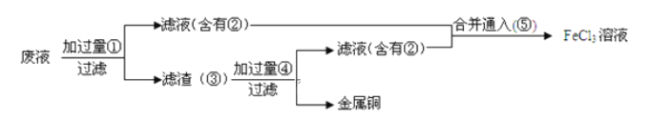
(1)请写出上述实验中加入或生成的有关物质的化学式:①______________,②______________
(2)滤渣加过量④的化学方程式______________
(3)含有②的滤液与⑤反应的化学方程式为______________
科目:高中化学 来源: 题型:
【题目】碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为(2x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑。生成物(1x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图:

(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是______。
(2)第②步操作的目的是除去粗盐中的______(填化学式,下同),第⑥步操作的目的是除去滤液中______。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、______(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是______。
(5)实验所得精盐的质量大于粗盐中NaCl的质量,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铝的几种重要化合物之间的转化关系,下列表述不正确的是( )
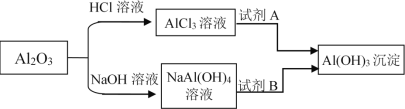
A.若加入的A是NaHCO3溶液,则生成沉淀的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,溶液的pH增大
B.若加入的B是NaHCO3溶液,则生成沉淀的离子方程式为:Al(OH)4- + HCO3-=Al(OH)3↓+CO32-+H2O,溶液的pH减小
C.向AlCl3溶液中加入一定质量的Al(OH)3固体,一段时间后过滤,将所得固体洗涤干燥,称量,固体质量将增加
D.若加入的A是氨水、NaOH溶液或CH3COONa溶液等;或加入的B是NH4HCO3溶液、NH4Cl溶液或通入SO2、CO2气体等,均可析出Al(OH)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着社会经济的发展,汽车已进入千家万户,它给人们出行带来方便的同时汽车尾气污染问题也日益突显,汽车尾气中含![]() 和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:
和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:![]() ,可实现氮氧化物无害转化。关于该反应下列说法不正确的是( )
,可实现氮氧化物无害转化。关于该反应下列说法不正确的是( )
A.升高温度能够加快反应速率
B.降低NO浓度能够减慢反应速率
C.使用合适的催化剂可以加快反应速率
D.加入足量的炭粉可以使![]() 转化
转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物6g完全燃烧,生成![]() 和
和![]() (标准状况下),0.5mol此有机物的质量为30g。
(标准状况下),0.5mol此有机物的质量为30g。
(1)通过计算确定该有机物的分子式:_________(写出必要的计算过程)
(2)该有机物有有多种同分异构体。其一能使紫色石蕊试液变红,则该有机物的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
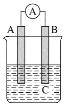
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Ag,B是Fe,C为稀AgNO3溶液
D.A是Fe,B是Ag,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面所示是实验室制取SO2,并验证SO2的某些性质的装置图。试回答:
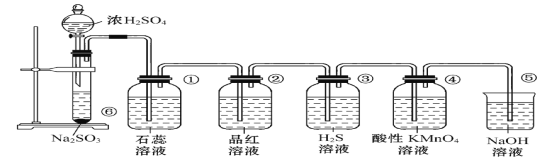
(1)②可证明SO2有___性;③可证明SO2有___性。
(2)④中的实验现象是__,证明SO2有___性。
(3)⑤的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OH![]() CH2=CH2↑+H2O),将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。(已知:乙烯可以被浓硫酸氧化,有SO2生成)
CH2=CH2↑+H2O),将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。(已知:乙烯可以被浓硫酸氧化,有SO2生成)
乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。
请你回答下列问题:
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是___________________。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中必定含有一种杂质气体是________,它与溴水反应的化学方程式是_________________。在验证过程中必须全部除去。为此,乙同学设计了如图所示的实验装置:

请回答:Ⅰ、Ⅱ、Ⅲ装置中可盛放的试剂是:Ⅰ________、Ⅱ________、Ⅲ________(填序号)。
A.品红 B.NaOH溶液
C.溴水 D.酸性高锰酸钾溶液
(3)为验证这一反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com